
27.(18分)下图是无机物A-M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I是由第三周期元素组成的单质中熔点最高的金属,K是一种红棕色气体。
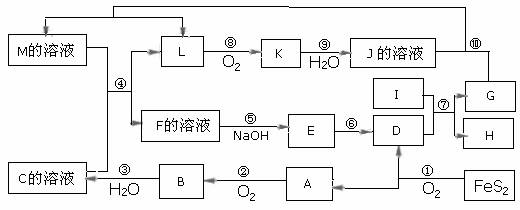
请填写下列空白:
(1)在周期表中,组成单质G的元素位于第__________周期_________族。
(2)在反应⑦中氧化剂与还原剂的物质的量之比为___________________。
(3)在反应②、③、⑥、⑨中,既属于化合反应又属于非氧化还原反应的是 ______(填写序号)。
(4)反应④的离子方程式是:____________________________________________
(5)若灼烧6g FeS2产生的A全部转化为B气体时放出9.83kJ热量,产生的B与水全部化合生成C,放出13.03kJ热量,写出B气体转化为C的热化学方程式: 。
(6)将化合物D 与KNO3、KOH 共融,可制得一种“绿色”环保高效净水剂K2FeO4 (高铁酸钾).同时还生成KNO2和H2O 。该反应的化学方程式是: 。
26.(18分)短周期元素A、B、C、D,A元素的原子最外层电子数是内层电子数的两倍,B为地壳中含量最多的元素,C是原子半径最大的短周期主族元素,C与D形成的离子化合物CD是常用的调味品。填写下列空白:
(1)A原子的结构示意图是 ,AB2的结构式是 ,CDB的电子式是 , CDB的水溶液呈 (填“酸”、“碱”“中”)性,其理由是(用离子方程式表示) ,溶液中离子浓度的大小顺序是 。
(2)A单质与B单质发生反应的产物有 。(填化学式)
(3)B、C组成的一种化合物与水发生化合反应的化学方程式为:
(4)如下图所示,取一张用CD溶液浸湿的pH试纸平铺在玻璃片上,取两根石墨棒做电极,接通直流电源。一段时间后,a电极处的pH试纸上可观察到的现象是 反应式为 。

(5)常温下,相同体积的0.2mol·L-1CD溶液与0.1mol·L-1 C2AB3溶液中,阳离子数目较多的是 溶液。(填化学式)
13.咖啡鞣酸具有较广泛的抗菌作用,其结构简式如图所示:关于咖啡鞣酸的下列说法不正确的是 ( )

A.分子式为C16H18O9
B.与苯环直接相连的原子都在同一平面上
C.咖啡鞣酸水解时可消耗8molNaOH
D.与浓溴水既能发生取代反应又能发生加成反应
第II卷
12.NA为阿佛加德罗常数,下列说法正确的是 ( )
A.在标准状况下,22.4LSO3所含分子数为NA
B.23gNa在空气中加热条件下反应,O2得到的电子数为2NA
C.32gO2和O3的质子数均为16NA
D.2L1mol/L的HCl溶液中,含有的HCl分子数目为2NA
11.只靠一组镍氢电池驱动,一台试运行的混合动力公交车两年内跑了10万公里。大功率镍氢动力电池及其管理模块,是国家“十五”863计划电动汽车重大专项中一项重要课题。我国镍氢电池居世界先进水平,我军潜艇将装备国产大功率镍氢动力电池。常见镍氢电池的某极是储氢合金LaNi5H6 (LaNi5H6中各元素化合价均为零),电池反应通常表示为
LaNi5H6
+ 6NiO(OH) LaNi5 + 6Ni(OH)2 ,下列说法正确的是 ( )
LaNi5 + 6Ni(OH)2 ,下列说法正确的是 ( )
A.放电时储氢合金作正极
B.充电时阳极周围c(OH-)增大
C.充电时储氢合金作阳极
D.放电时负极反应:LaNi5H6+6OH――6e-=LaNi5+6H2O
10.将 4 mol A 气体和 2 mol B 气体在 2 L 的密闭容器中混合并在一定条件下发生如下反应 2A(g)+B(g) 2C(g);△H
<0,4 s(秒)后反应达到平衡状态,此时测得C的浓度为0.6
mol·L-1 ,下列说法中正确的是 ( )
2C(g);△H
<0,4 s(秒)后反应达到平衡状态,此时测得C的浓度为0.6
mol·L-1 ,下列说法中正确的是 ( )
A.反应过程中,当A 、B、C的物质的量浓度之比为 2:1:2时,反应即达到平衡状态
B.4 s 内用物质B表示的反应速率为0.075 mol·L-1·S-1
C.达平衡后若增大压强,A的转化率降低
D.达平衡后若升高温度,C的浓度将增大
8.下列叙述正确的是 ( )
A.室温下pH=7的CH3COOH与CH3COONa的混合液中离子的浓度大小顺序为:
c(Na+)> c(CHCOO-)> c(H+)= c(OH-)
B.0.1 mol/L KHS的溶液中,c(K+)= 2c(S2-)+ c(HS-)+ c(H2S)
C.25℃ 时,pH均为12的NaOH溶液和Na2CO3溶液中由水电离出的c(OH-),前者小于后者
D.中和pH和体积相同的盐酸与醋酸溶液,消耗NaOH的物质的量相等
|
①无色溶液中:K+、Na+、MnO4-、SO42-
②pH=11的溶液中:CO32-、Na+、AlO2-、NO3-
③加入Al能放出H2的溶液中:Cl-、HCO3-、SO42-、NH4+
④由水电离出的c(OH-)=10-13mol·L-1的溶液中:Na+、Ba2+、Cl-、Br-
⑤有较多Fe3+的溶液中: Na+、NH4+、SCN-、HCO3-
⑥酸性溶液中:Fe2+、Al3+、NO3-、I-、Cl-
A.①② B.③⑥ C.②④ D.③⑤
7.苏丹红是很多国家禁止用于食品生产的合成色素。结构简式如下图。关于苏丹红说法错误的是 ( )
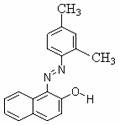
A.分子中含一个苯环和一个萘环
B.属于芳香烃
C.能被酸性高锰酸钾溶液氧化
D.能溶于苯
6.某学生的实验报告中有下列数据,其中合理的是 ( )
①用托盘天平称取11.7 g氯化钠
②用100 mL的量筒量取21.48 mL盐酸
③用容量瓶配制216 mL1 mol·L-1的氯化钠溶液
④用酸式滴定管量取25.00 mL H2SO4溶液
⑤用pH试纸测定H2SO4溶液的pH为3.2
A.①④ B.②④ C.①③ D.②⑤
25.(17分)某校化学兴趣小组的同学设计以下实验来定性检验茶叶中含有Ca、Al、Fe三种元素。因茶叶中Ca、Al、Fe元素含量较低,所以实验时称取茶叶10 g查阅资料:
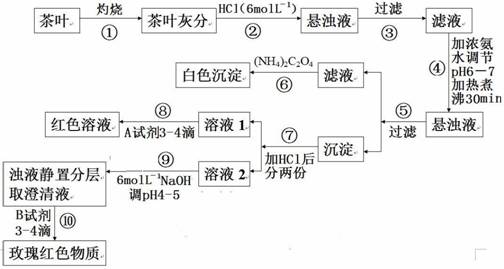
(1)草酸铵[(NH4)2C2O4]溶解度不大,为弱电解质。
(2)茶叶中的钙、铝、铁三种元素在空气中灼烧后转化成CaO、Al2O3、Fe2O3
(3)Ca2+、Al3+、Fe3+完全转化为氢氧化物沉淀的pH为:Ca(OH)2;pH≥13;Fe(OH)3; pH≥4.1
Al(OH)3;pH≥6.5
(4)在微酸性溶液中,Al3+与铝试剂[(NH4)3C19H11O3(COO)3]反应,生成玫瑰红色物质.
根据上述过程或信息填空:
(1)过滤所需要的玻璃仪器有:______________ ,_______________ ,_____________ 。
(2)步骤④用氨水调pH,可否用比较浓的烧碱溶液代替氨水?_____________ ;原因是:_____________
(3)写出检验Ca2+的离子方程式为:_____________
(4)写出第⑤步得沉淀所含主要物质的化学式:_____________
(5)写出步骤⑧的离子方程式:_____________
(6)步骤⑨的目的是:_____________ ;猜测步骤⑩的目的是:_____________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com