
28.(共14分)
X、Y、Z、W均为含有10电子的微粒,W为离子,X、Y、Z为分子,且X与Z分子中含有的共用电子数之比为3:4。
(1)X的电子式 ;若实验室用如图所示装置制取X,其化学反应方程式为 。

(2)已知:W+X+H2O→白色沉淀,为进一步确定W,进行如下实验。
请补全实验操作,现象和结论:取上述白色沉淀少量置于试管中,
。
(3)常温下,取10mL pH=a的Y的稀溶液,加水稀释时pH随溶液体积的变化如图所示,则Y的化学式为 ;下列叙述正确的是(填序号) 。
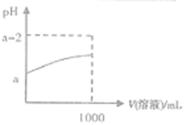
①Y溶于水部分电离
②稀释后所有离子的浓度均减小
③Y的水溶液通常保存在玻璃瓶中
④稀释后,阴离子的物质的量浓度之和增大
(4)已知H2的燃烧热285.8kJ/mol。现有Z和H2的混合气体共0.2mol,与O2完全燃烧生成H2O(1)和CO2(g),转移电子的物质的量为1.0mol,放出的热量为117.6kJ。则Z完全燃烧的热化学反应方程式为:
;
Z和O2在KOH溶液中构成燃料电池的负极的电极反应式为:
。
27.(共17分)
乙二酸通常以二水合物的形式存在,俗称草酸晶体。已知草酸晶体在101℃时熔化并开始升华,157℃时大量升华,继续升温会分解生成CO、CO2和H2O。
(1)下列关于乙二酸的叙述正确的是(填序号) 。
①能和乙二酸发生酯化反应 ②能使酸性高锰酸钾溶液褪色
③其溶液能使蓝色石蕊试纸变红 ④能和碳酸氢钠溶液反应生成气体
欲验证上述性质,除用到胶头滴管、试管和玻璃导管外,还必需要使用的玻璃仪器有 。
(2)乙二酸的工业生产方法之一是以乙二醇为原料,在一定条件下用空气氧化得到。写出该反应的化学方程式 。
(3)欲检验草酸晶体受热分解的产物中是否有CO2,甲、乙两位同学分别设计了装置1、装置2(见图)来完成实验(部分夹持装置已略去)。
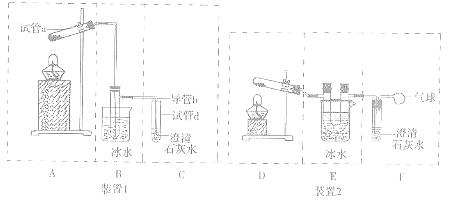
(I)简述检验装置I气密性的操作方法 。
(II)B和E两个装置中更合理的是 ,理由为
。
(III)请从A-F中选择合适的仪器,组装一套可更好达到实验目的的装置,按照气流由左到右的顺序依次为(用字母表示): 。
26.(共13分)
现有中学化学常见的物质X、Y、甲、乙、丙、丁,它们之间的反应关系为(反应条件略去);
①单质X+化合物甲→单质Y+化合物乙;②单质Y+化合物丙→化合物丁。
请针对以下不同情况回答:
(1)若乙为有磁性的化合物,反应①的化学方程式是 。
(2)若X、Y为不同种金属,甲为红棕色固体,工业上常用电解乙来制取X,X阳离子的结构示意图为 ,反应②的离子方程式是 。
(3)若X、Y为不同主族非金属气态单质,甲常温下呈液态,丁溶于水形成的溶液呈强酸性,则X的化学式是 ,反应②的化学方程式是 。
(4)除上述给定的情况外,请再写出一组同时符合反应①、②转化关系的化学方程式(反应条件略去)。
反应① 。
反应② 。
25.(共16分)
芳香族化合物X常用于制造农药、感光材料等。X由碳、氢、氧三种元素组成,相对分子质量为136,其中碳,氢元素的质量分数之和为76.5%。结构分析表明X中含有一个甲基,苯环上的一氯代物有两种。X经热的酸性KMnO4溶液处理后,转化为Y,1molY与足量NaHCO3溶液反应生成标准状况下44.8L CO2气体。
试回答下列问题:
(1)X的分子式为 ,Y中含氧官能团的名称为
(2)已知A、B、C、D与X互为同分异构体,且均是一取代芳香族化合物,其中可以发生银镜反应。相关反应如下:

①A、D的结构简式分别为A 、D 。
②C与足量的NaOH溶液加热时发生反应的化学方程式为:
,
该反应中涉及到的有机反应类型为 。
③属于芳香族化合物的E的同分异构体有 种。
④足量的G与Y在一定条件下发生反应的化学方程式为:
。
12.将a LSO3气体通过灼热的装有催化剂(V2O5)的硬质玻璃管,反应后测得气体体积增大了b L(气体体积均在同温同压下测定),则下列叙述正确的是 ( )
A.SO3的转化率为
B.混合气体的平均相对分子质量为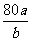
C.反应前与反应后气体的密度之比为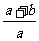
D.混合气体中SO2的体积分数为
第Ⅱ卷(非选择题 共180分)
本卷共11小题,共180分。
11.常温下,0.2mol/L CH3COOH溶液与0.1mol/L NaOH溶液等体积混合后(忽略混合前后溶液体积的变化),溶液的pH<7,则下列有关此溶液的叙述正确的是 ( )
A.溶液中由水是离产生的H+浓度为1×10-7mol/L
B.c(CH3COO-)+c(CH3COOH)-c(Na+)=0.05mol/L
C.溶液中CH3COOH的电离程度小于CH3COONa的水解程度
D.溶液中离子浓度的大小关系为:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
10.电浮选凝聚法是工业上采用的一种污水处理方法,下图是电解污水的实验装置示意图,实验用污水中主要含有可被吸附的悬浮物(不导电)。下列有关推断明显不合理的是
( )
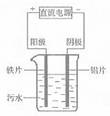
A.阴极的电极反应式为:O2+4e-+2H2O=4OH-
B.通电过程中烧杯内产生可以吸附悬浮物的Fe(OH)3
C.通电过程中会产生气泡,把悬浮物带到水面形成浮渣弃去
D.如果实验用污水导电性不良,可加入少量Na2SO4固体以增强导电性
9.下表中的实验,“操作和现象”与“结论”对应关系正确的一组是 ( )
|
|
操作和现象 |
结论 |
|
A |
向纯碱中滴加足量浓盐酸,将所得气体通入苯酚钠溶液中,溶液变浑浊 |
酸性:盐酸>碳酸>苯酚 |
|
B |
取某溶液少量,加入盐酸酸化的BaCl2溶液,出现白色沉淀 |
该溶液中一定含有大量的SO42- |
|
C |
取少量Fe(NO3)2试样加水溶液后加稀H2SO4酸化,滴加KSCN溶液,溶液变为红色 |
该Fe(NO3)2试样已经变质 |
|
D |
取皂化反应后的混合液滴入盛水的烧杯中,在液体表面出现油滴 |
皂化反应不完全 |
8.下列说法正确的是 ( )
A.由于H2O分子间存在氢键,所以H2O比H2S稳定
B.11.2 L O2和CO2的混合气体中含有6.02×1023个氧原子
C.SO2溶于水能导电,它是电解质
D.可逆反应达平衡状态后,化学反应速率发生变化,平衡不一定移动
7.下列离子方程式书写正确的是 ( )
A.氯气与水反应:Cl2+H2O=2H++Cl-+ClO-
B.铝与氢氧化钠溶液反应:Al+2OH-==AlO2-+H2↑
C.碘化钾溶液酸化后滴入少量双氧水:2I-+2H++H2O2=I2+2H2O
D.工业上用三氯化铁溶液腐蚀印刷电路板:2Fe3++3Cu=3Cu2++2Fe
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com