
1.下列涉及有机物的性质或应用的说法不正确的是
A.干馏煤可以得到甲烷、苯和氨等重要化工原料
B.用于奥运“祥云”火炬的丙烷是一种清洁燃料
C.用大米酿的酒在一定条件下密封保存,时间越长越香醇
D.油脂都不能使溴的四氯化碳溶液褪色
29.(15分)近年来,国际原油价格大幅上涨,促使各国政府加大生物能源生产,其中酒精汽油已进入实用化阶段。
(1)柴油是含C15~C18的碳氢化合物的混合物,这些碳氢化合物属于有机物中的____类。
(2)乙醇在铜或银作催化剂的条件下,可以被空气中的氧气氧化成X,X的结构简式是_________________。
(3)乙醇可以与酸性重铬酸钾溶液反应,被直接氧化成Y,Y 含有官能团的名称是_________。在浓硫酸作用下,乙-丙醇与Y反应可生成一种有香味的物质W,化学方程式为________________________________________________。
(4)现有两瓶无色液体,分别盛有Y、W,只用一种试剂就可以鉴别,该试剂可以是__________ 或_____________。
(5)工业上通过乙烯与水在一定条件下反应制得乙醇,反应类型是______________;现代石油化工采用银作催化剂,乙烯能被氧气氧化生成环氧乙烷 ,该反应的原子利用率为100%,反应的化学方程式为_________
。
,该反应的原子利用率为100%,反应的化学方程式为_________
。
28.(13分)请分析回答某同学在探究浓硫酸、稀硫酸、浓硝酸、稀硝酸分别与铜反应的实验中发生的有关问题。探究上述四种酸氧化相对强弱及其与铜反应的还原产物的性质
(1)分别向盛有等量铜片的四支试管中加入等体积的①浓硫酸 ②稀硫酸 ③浓硝酸 ④稀硝酸,能随即发生反应的是(填序号,下同) , 微热则发生反应的是 ,加热后发生反应的是 , 加热也不发生反应的是 。由此可以得到上述四种酸氧化性由强到弱的顺序是:
(2)先将铜与浓硫酸反应产生的气体X持续通入下图装置中,一段时间后再将铜与浓硝酸反应产生的大量气体Y也持续通入该装置中,可观察到的现象包括(可选多项,但多选倒扣分,下同)
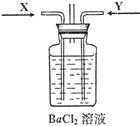
A.通入X气体后产生白色沉淀
B.通入X气体后溶液中无明显现象
C.通入Y气体后开始沉淀
D.通入Y气体后沉淀溶解
E.通入Y气体后溶液中无明显现象
(3)由此可得到的结论是
A.HNO3的酸性比H2SO4强
B.盐酸的酸性比H2SO3强
C.BaSO3能溶于盐酸
D.HNO3能氧化H2SO3(或SO2)
E.BaSO4不溶于水也不溶于HNO3溶液
27.(16分)已知化合物A、B、C、D、E、F、G和单质甲、乙所含元素均为短周期元素,A的浓溶液与甲能发生如图所示的反应。甲是常见的固体单质,乙是常见的气体单质,B、D是无色气体,B是主要的大气污染物之一,请根据下图所示回答问题。
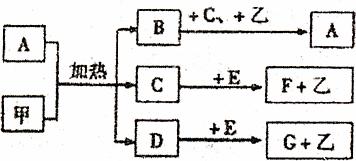
(1)写出下列物质的化学式:A ,G 。
写出反应C+E→F+乙的化学方程式: 。
每生成1mol乙气体,需要转移 mol电子。
(2)气体B可用与B含有同一种元素的气体化合物M与其发生氧化还原反应而转化,M的化学式是 ,M与B反应的化学方程式 。
(3)G溶液与D反应生成酸式盐,该酸式盐溶液与F溶液反应又生成G,写出反应的化学方程式 。
26.(16分)(1)实验室为监测空气中汞蒸气的含量;往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应为:
4CuI+Hg=Cu2HgI4+2Cu
①上述反应产物Cu2HgI4中的Cu元素显 价。
②以上反应中的氧化产物为 ,当有1molCuI参与反应时,转移电子为 mol
③CuI可由Cu2+与I-直接反应制得,请配平下列反应的离子方程式
Cu2++ I-→ CuI+ I3-
(2)铜是重要的金属材料 。
①工业上可用Cu2S和O2反应制取粗铜,该反应中氧化剂为 。电解粗铜制取精铜,电解时,阳极材料是 ,电解液中必须含有的阳离子是 。
②在100mL 18mol/L浓硫酸中加入过量的铜片,加热使之充分反应,反应中被还原的H2SO4< mol。
13.咖啡鞣酸具有较广泛的抗菌作用,结构简式如图所示:下列关于咖啡鞣酸的说法,不正确的是 ( )

A.分子式为C16H18O9
B.在一定条件下能发生消去反应
C.1mol咖啡鞣酸水解时可消耗8molNaOH
D.与浓溴水既能发生取代反应又能发生加成反应
第Ⅱ卷(非选择题,共174分)
12.下列叙述不正确的是 ( )
A.c(NH+4)相等的(NH4)2SO4溶液、(NH4)2Fe(SO4)2溶液和NH4Cl溶液中,溶质浓度大小关系是:c[(NH4)2Fe(SO4)2]<c[(NH4)SO4]<c(NH4Cl)
B.向AgCl悬浊液中滴入KI溶液,有AgI沉淀生成,说明AgCl的溶解度大于AgI的溶解度
C.0.2mol/L HCl溶液与等体积0.05mol/L Ba(OH)2溶液混合后,溶液的pH=1
D.0.2mol/L的NaHCO3溶液中c(H+)+c(H2CO3)=c(CO2-3)+c(OH-)
11.下列离子方程式正确的是 ( )
A.向Ba(OH)2溶液中滴加NH4HSO4溶液至刚好沉淀完全:
Ba2++2OH-+NH4++2H++SO42-=BaSO4↓+H2O+NH3·H2O
B.澄清石灰水与稀盐酸反应:Ca(OH)2+2H+=Ca2++2H2O
C.钠与水反应:Na+2H2O=Na++2OH-+H2↑
D.碳酸钡中加入稀硫酸:BaCO3+2H+=Ba2++CO2↑+H2O
10.将标准状况下,将VLA气体(摩尔质量为Mg/mol)溶于0.1L水中,所得溶液密度为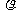 g/cm3,则此溶液的物质的量浓度(mol/L)为 ( )
g/cm3,则此溶液的物质的量浓度(mol/L)为 ( )
A.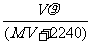 B.
B.
C.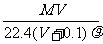 D.
D.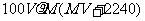
9.已知:①向KMnO4晶体滴加浓盐酸,产生黄绿色气体;②向FeCl2溶液中通入少量实验③产生的气体,溶液变黄色;④取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色。下列判断正确的是 ( )
A.上述实验证明氧化性:MnO4->Cl2>Fe3+>I2
B.上述实验中,共有两个氧化还原反应
C.实验①生成的气体不能使湿润的淀粉KI试纸变蓝
D.实验②证明Fe2+既有氧化性又有还原性
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com