
29.(16分)某有机化合物D,其相对分子质量为166,取8.3g该物质完全燃烧得到CO2与H2O的物质的量之比是9:5。回答下列问题:
(1)D的分子式为: ;
(2)已知其分子结构中含有一个苯环,苯环的两个邻位有取代基。进一步实验可知:
①D能与碳酸氢钠溶液反应生成无色无味气体。②8.3gD物质与足量金属钠反应可生成氢气1.12L(标准状况)。③D不能与FeCl3溶液发生显色反应。④D不能发生消去反应。请写出符合上述条件的D的所有同分异构体的结构简式:
(3)已知D的一种同分异体有以下转化关系。取C在NaOH水溶液中反应后的混合液,加入足量硝酸酸化后,再加入硝酸银溶液,出现白色沉淀。E分子中有两个六元环结构。
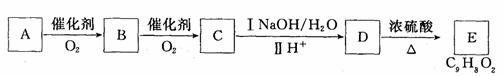
①A的结构简式为 ;
②上述转化过程中涉及到的反应类型有(填选项) ;
A.氧化反应 B.加成反应 C.取代反应 D.聚合反应
③写出由A→B的化学方程式: ;
写出由D→E的化学方程式: 。
28.(14分)某研究性学习小组从网上查到绿矾(FeSO4·7H2O)受热分解的方程式为:
2FeSO4·7H2O Fe2O3+SO3↑SO3↑+14H2O↑,就设计了如下实验装置来验证绿矾受热分解是否发生上述反应。
Fe2O3+SO3↑SO3↑+14H2O↑,就设计了如下实验装置来验证绿矾受热分解是否发生上述反应。
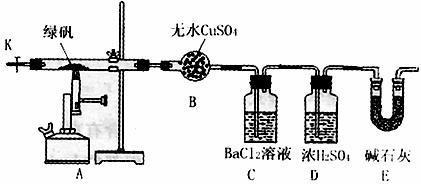
主要实验步骤如下:
①组装仪器并检查装置的气密性;
②称量绿矾样口及U型干燥管E的质量,将称量后的绿矾置于硬质玻璃管内;
③关闭活塞K,加强热使绿矾完全分解;
④打开活塞K,缓缓鼓入一定量的氮气;
⑤再次称量干燥管E的质量;
⑥重复④⑤的操作,直到干燥管E的质量基本不变为止;
⑦称量洗气瓶C中所得沉淀的质量。
试回答:
(1)洗气瓶D中浓H2SO4的作用为: ;
(2)步骤⑦从溶液中获取生成沉淀质量的具体操作为: ;
(3)实验小组的报告如下,请补充完整:
|
|
实验记录 |
分析或计算结果 |
|
现象 |
硬质管内绿色变为红棕色; |
生成物有
|
|
干燥管B中晶体白色变蓝色。 |
生成物有H2O |
|
|
数据 |
称取绿矾样品16.68g; |
反应的绿矾0.06mol |
|
干燥管E最后增重2.24g; |
生成SO2 mol |
|
|
C中生成白色沉淀的质量为4.66g; |
生成DO3 0.02mol |
(4)该实验所得到的数据与所得到的化学方程式中的定量关系不相符合,请分析可能的原因。
(5)为达到“验证绿矾受热分解是否发生上述反应”的目的,该实验的设计有多处不妥,请提出改进建议(两条即可)
27.(12分)A、B、C三种物质中均含有同一种元素,它们之间有如下图所示的转化关系(部分反应物质已略去)。

(1)若A是一种两性氧化物,B的水溶液呈酸性,请写出反应①和反应④(由A一步转化为B或C)的离子方程式:反应① 、反应④ ;
(2)若反应①为置换反应,反应④为化合反应,C物质大量存在于海水中,是人体生理活动不可缺少的物质。工业上可以用C来制取A或B,请写出这两个反应的化学方程式:C→A ;C→B ;
(3)若反应①②③均为化合反应,反应④为置换反应。当A为一种金属单质时,请写出反应②和③可能的离子方程式:② ;③ 。
13.将一定质量的镁、铜组成的混合物加入到稀硝酸中,金属完全溶解(假设反应中还原产物全部是NO)。向反应后的溶液中加入3mol/LNaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g,则下列叙述中正确的是 ( )
A.当生成沉淀达到最大量时,消耗NaOH溶液的体积为100mL
B.当金属全部溶解时收集到NO气体的体积为2.24L
C.参加反应的金属的总质量一定是6.6g
D.当金属全部溶解时,参加反应的硝酸的物质的量一定是0.4mol
第Ⅱ卷(非选择题,共174分)
请回答以下问题:
(1)请画出F的离子结构示意图: ;由C、A两种元素形成的18电子化合物的电子式为 ;
(2)工业上制取E单质的化学方程式为: ;
(3)由以上六种元素两两组合所形成的化合物中,既含有离子键又含有非极性共价键的常见化合物有 和 (填化学式);它们都能与水反应生成气体,写出其中一个属于非氧化还原反应的化学方程式 ;
(4)由A、B两种元素形成的正四面体分子是一种常见的气体燃料。通常状况下1g该物质完全燃烧生成液态水时所释放的能量为51.25kg/mol,请写出表示其燃烧热的热化学方程式: ;
(5)下图是中学常见的几种晶体结构。有关说法正确的是 (填选项)。
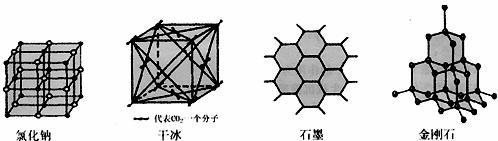
A.氯化钠的晶体结构中,和钠离子最近且等距离的氯离子组成了一个正八面体
B.干冰晶体是CO2分子通过范德华力结合形成的
C.石墨晶体中碳原子数与所形成的共价键数目之比为2:3
D.金刚石晶体是由五个碳原子形成的正四面体分子构成的
12.下图是某反应体系中的三种气态物质M、N、P的物质的量浓度随时间的变化情况,则下列判断不正确的是 ( )

A.该反应的化学方程式可表达为:2M+N 2P
2P
B.在反应时间为20min-25min之内,物质M的反应速率为0.002mol/(L·min)
C.当反应时间为20min时,曲线开始发生变化的原理可能是由于增大压强引起的
D.反应在10min达到化学平衡状态,若曲线的变化是由于升温造成的(其它条件不变),则该反应的正反应一定为吸热反应
11.下列叙述正确的是 ( )
A.向CH3COONa的稀溶液中加入少量CH3COONa晶体,则溶液中的 比值变大
比值变大
B.体积为VL的Na2CO3溶液pH=a,加水后使其体积为10V时,其溶液的pH=a-1
C.pH=11的KOH溶液与pH=3的醋酸溶液等体积混合,滴入酚酞后溶液呈红色
|
10.下图中甲、乙两个装置用导线连接,有关叙述正确的是 ( )
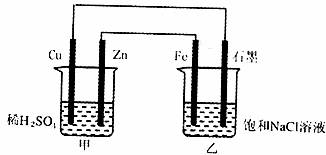
A.甲装置中Cu为阳极,乙装置Fe为负极
B.甲装置中SO2-4向Cu极移动,乙装置中的Na+向石墨极移动
C.乙烧杯中Fe极的电极反应式为:2H2O+2e-=2OH-+H2↑
D.当石墨电极上产生11.2L(标准状况)气体时,消耗Zn的质量为65g
9.有Fe2+、NO-3、Fe3+、NH+4、H+和H2O六种粒子,分别属于同一个氧化还原反应中的反应物和生成物。下列叙述正确的是 ( )
A.反应中NH+4被氧化
B.氧化剂与还原剂的物质的量之比为8:1
C.若有10molH+参加反应,则生成的水的物质的量为5mol
D.生成物中加入KSCN溶液后变红色
8.下列离子方程式正确的是 ( )
A.把CO2通入CaCl2溶液:Ca2++CO2+H2O==CaCO3↓+2H+
B.Al和NaOH溶液反应:Al+2OH-=AlO-2+H2↑
C.把SO2通入酸性KMnO4溶液中:5SO2+2MnO-4+2H2O=5SO2-4+2Mn2++4H+
D.NaAlO2溶液中通入过量CO2气体:2AlO-2+CO2+3H2O=2Al(OH)3↓+CO2-3
7.下列选项中,可以用图表示物质或概念间的从属关系的是 ( )
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com