
30.[化学--物质结构与性质](13分)
研究物质的微观结构,有助于人们理解物质变化的本质。请回答下列问题。
(1)C、Si、N元素的电负性由大到小的顺序是________________________________。C60和金刚石都是碳的同素异形体,金刚石熔点高于C60的熔点,原因是__________。
(2)A、B均为短周期金属元素。依据下表数据,写出B原子的电子排布式:_______
电离能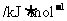 |
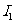 |
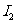 |
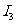 |
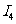 |
|
A |
932 |
1821 |
15390 |
21771 |
|
B |
738 |
1451 |
7733 |
10540 |
(3)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般地为d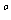 或d
或d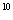 排布时,无颜色;为d
排布时,无颜色;为d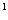 一d
一d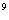 排布时,有颜色,如[Co(H
排布时,有颜色,如[Co(H O)
O)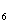 ]
]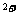 显粉红色。据此判断,[Mn(H
显粉红色。据此判断,[Mn(H O)
O)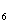 ]
]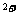 _______颜色(填“无”或“有”)。
_______颜色(填“无”或“有”)。
(4)利用CO可以合成化工原料COCl2、配合物Fe(CO)5等。
①COCl2分子的结构式为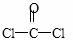 ,COCl2分子内含有 (填标号)。
,COCl2分子内含有 (填标号)。
A.4个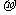 键
B.2个
键
B.2个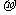 键、2个
键、2个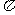 键
键
C.2个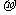 键、1个
键、1个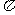 键 D.3个
键 D.3个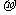 键、1个
键、1个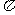 键
键
②Fe(CO)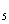 在一定条件下发生分解反应:Fe(CO)
在一定条件下发生分解反应:Fe(CO)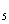 ===Fe(s)+5CO,反应过程中,断裂的化学键只有配位键。形成的化学键是___________。
===Fe(s)+5CO,反应过程中,断裂的化学键只有配位键。形成的化学键是___________。
25.(16分)
黄铁矿是我国大多数硫酸厂制取硫酸的主要原料。某化学兴趣小组对某黄铁矿石(主要成分为FeS )进行如下实验探究。
)进行如下实验探究。
[实验一]测定硫元素的含量
Ⅰ.将m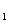 g该黄铁矿样品放入如下图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:
g该黄铁矿样品放入如下图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:
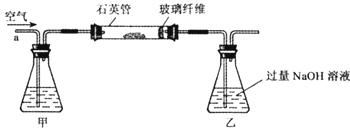
Ⅱ.反应结束后,将乙瓶中的溶液进行如下处理:

问题讨论:
(1)Ⅰ中,甲瓶内所盛试剂是____________溶液。乙瓶内发生反应的离子方程式有________________________、________________________。
(2)Ⅱ中,所加H O
O 溶液(氧化剂)需足量的理由是_______________________。
溶液(氧化剂)需足量的理由是_______________________。
(3)该黄铁矿石中硫元素的质量分数为____________________________ 。
[实验二]设计以下实验方案测定铁元素的含量
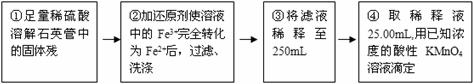
问题讨论:
(4)③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有________。
(5)②中,若选用铁粉作还原剂。你认为合理吗?理由是:
_______________________________________________________________________
选考部分
第II卷选考部分共5题,共35分。其中,第28、29题为物理题,第30、31题为化学题,考生从两道物理题、两道化学题中各任选一题作答,若第28、29题都作答,则按第28题计分,若第30、31题都作答,则按第30题计分;第32题为生物题,是必答题。请将答案都填写在答题卡选答区域的指定位置上。
24.(14分)
重铬酸钠(Na Cr
Cr O
O )广泛用于合成颜料、媒染剂等。以铬铁矿(主要成分为Cr
)广泛用于合成颜料、媒染剂等。以铬铁矿(主要成分为Cr O
O 还含有FeO、Al
还含有FeO、Al O
O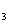 、SiO
、SiO 等杂质)为原料制取重铬酸钠的流程图如下:
等杂质)为原料制取重铬酸钠的流程图如下:
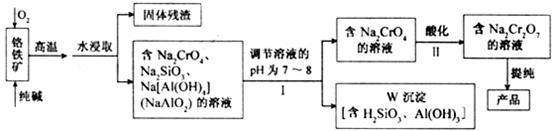
请回答下列问题。
(1)若I中只用一种试剂调节溶液的pH,应选用___________(填标号)。
A.稀硫酸 B.氧化钠固体 C.氢氧化钾溶液
(2)I中,调节溶液pH后,如果溶液的pH过小,可能导致W沉淀部分溶解,原因是 __________________________________________________ (用离子方程式表示)。
(3)Ⅱ中,Na CrO
CrO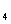 转化为Na
转化为Na Cr
Cr O
O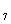 的离子反应如下:
的离子反应如下:
2CrO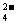 (黄色)+2H
(黄色)+2H
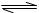 Cr
Cr O
O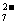 (橙红色)+H
(橙红色)+H O
O
①该反应________氧化还原反应(填“是”或“不是”),反应的平衡常数表达式 K=________________。
②若往Na Cr
Cr O
O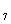 溶液(橙红色)中加入足量NaOH固体,溶液_______(填标号)。
溶液(橙红色)中加入足量NaOH固体,溶液_______(填标号)。
A.变黄色 B.颜色不变 C.橙红色变深
③已知:25℃时,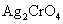 的
的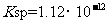 ,
,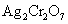 的
的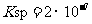 。
。
25℃时,往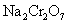 溶液中加入
溶液中加入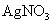 溶液,最终只生成一种砖红色沉淀,该沉淀的化学式是_____________________。
溶液,最终只生成一种砖红色沉淀,该沉淀的化学式是_____________________。
23.(15分)
W、X、Y、Z 4种短周期元素在元素周期表中的位置如下图所示,其中Z位于ⅦA族。请回答下列问题。
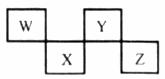
(1)W的原子结构示意图为____________。能说明Z的非金属性比X的非金属性强的事实是_________________ (举一例)。
(2)W、Y和氢3种元素所形成的一种化合物,其75%(体积分数)的溶液常用于医疗消毒,该化合物的结构简式为________________________。
(3)电解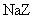 水溶液时,阴极的电极反应式为________________________________。
水溶液时,阴极的电极反应式为________________________________。
工业上,以上述反应的阳极产物和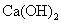 为原料,制备漂白粉反应的化学方程 式为________________________________________________________________。
为原料,制备漂白粉反应的化学方程 式为________________________________________________________________。
|
 气体反应,生成lmol Na
气体反应,生成lmol Na Y固体时。放出热量414kJ;生成1mol Na
Y固体时。放出热量414kJ;生成1mol Na Y
Y 固体时,放出热量511kJ。由Na
固体时,放出热量511kJ。由Na Y固体与Y
Y固体与Y 气体反应生成Na
气体反应生成Na Y
Y 固体的热化学方程式为_____________________________________。
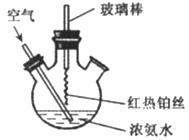
固体的热化学方程式为_____________________________________。12.在下图所示装置中进行氨的催化氧化实验:往三颈瓶内的浓氨水中不断通入空气,将红热的铂丝插入瓶中并接近液面。反应过程中,可观察到瓶中有红棕色气体产生,铂丝始终保持红热。下列有关说法错误的是 ( )
( )
A.反应后溶液中含有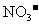

B.反应后溶液中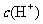 增大
增大
C.实验过程中有化合反应发生
D.实验过程中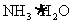 的电离常数不可能发生变化
的电离常数不可能发生变化


第Ⅱ卷
必考部分
第II卷必考部分共9题,共157分。
11.某原电池构造如下图所示。下列有关叙述正确的是 ( )
( )
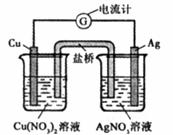
A.在外电路中,电子由银电极流向铜电极
B.取出盐桥后,电流计的指针仍发生偏转
C.外电路中每通过0.1mol电子,铜的质量理论上减小6.4g
D.原电池的总反应式为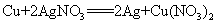

10.下列各组单质中,前者能将后者从化合物中置换出来的是 ( )
( )
①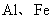 ②
②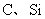 ③
③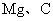 ④
④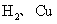

A.只有①③ B.只有②④ C.①②③④ D.只有①②④
9.下列说法正确的是 ( )
( )
A.用粮食酿酒的过程中,不可能生成乙酸
B.蛋白质、橡胶和塑料都是天然高分子
C.煤的干馏产物中不含烃
D.乙烯能使溴的四氯化碳溶液褪色,与乙烯分子含有碳碳双键有关
8.标准状况下,均含有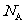 个电子的H
个电子的H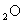 和CH
和CH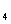 ,具有相同的
,具有相同的 ( )
( )
A.质量 B.体积 C.物质的量 D.氢原子数
7.常温下,将等物质的量浓度、等体积的烧碱溶液和乙酸溶液混合,充分反应后溶液的pH
( )
A.小于7 B.大于7 C.等于7 D.无法判断
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com