
17.(10分)工业上可利用合成气(CO和H2的混合气体)生产甲醇(如反应④)。已知:
①CO(g)+O2(g)=CO2(g) △H=-283.0kJ/mol
②H2(g)+O2(g)=H2O(l) △H=-285.8kJ/mol
③CH3OH(g)+O2(g)=H2O(l) △H=-761.7kJ/mol
④CO(g)+2H2(g)=CH3OH(g)
(1)反应④的△H= ,△S (填“>”“<”或“=”)。
(2)在一定条件下,反应④在一密闭容器中达到平衡。维持H2浓度和容器的温度不变,
增大容器的体积,平衡将 (填字母)。
A.向正反应方向移动 B.向逆反应方向移动
C.不移动 D.无法判断
(3)工业上用反应④低压合成甲醇,在230℃-270℃最为有利。为研究合成气最合适的起始组成比,分别在230℃、250℃和270℃进行实验,结果如图。

230℃的实验结果所对应的曲线是 (填字母);
工业生产适宜采用的合成气组成比n(H2)∶n(CO)的范围应是 。(填字母)
A.1∶1-1.5∶1
B.2.2∶1-3∶1
C.3.5∶1-4.5∶1
(4)原料气中含有少量CO2对CO合成甲醇的转化率有一定影响。科学家为研究这一影响,在同一容器中分别进行以下5组实验。
|
组别 |
原料气中各组分的体积分数 |
|||
|
CO |
CO2 |
H2 |
N2 |
|
|
第1组 |
19.7 |
0.0 |
59.1 |
21.2 |
|
第2组 |
20.7 |
0.3 |
62.1 |
16.9 |
|
第3组 |
16.9 |
1.3 |
50.7 |
31.1 |
|
第4组 |
19.8 |
5.5 |
59.4 |
15.3 |
|
第5组 |
20.3 |
10.9 |
60.9 |
7.9 |
表中5组实验中,控制不变的实验条件是压强、催化剂、 、 等。
16.(8分)根据下列框图回答有关问题(答题时,方程式中的E用所对应的元素符号表示):
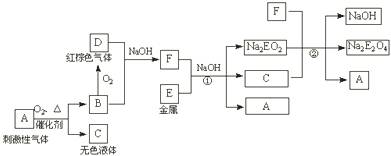
已知:Na2EO2溶于过量的新制氯水,形成黄色溶液,向该溶液中滴加KSCN溶液立即出现红色,振荡,一段时间后,红色褪去。
(1)A的电子式为 。
(2)写出反应②的化学方程式 。
(3)写出Na2EO2与新制氯水反应的离子方程式 。
(4)一段时间后红色褪去的原因可能是:
①E元素被氯水氧化为更高价态的物质;
② 。
15.(10分)某种胃药中止酸剂为CaCO3。为测定其中CaCO3含量,某研究小组设计以下两种方案(药片中的其它成分与HCl和NaOH溶液均不反应)。请回答有关问题:
(1)方案一:用下图装置测量一定量样品与足量稀盐酸反应生成CO2的体积,计算CaCO3的含量;装置中连通管X的作用是 、 。
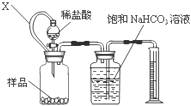
(2)方案二:用滴定法测定,有以下几步操作:
A.配制0.100mol/L HCl溶液和0.100mol/L NaOH溶液
B.取一粒药片(0.100g),研碎后加入20.0mL蒸馏水
C.以酚酞为指示剂,用0.100mol/L NaOH溶液滴定,用去体积为VmL达到终点
D.用酸式滴定管加入25.00mL 0.100mol/L HCl溶液,充分反应
①测定过程的正确操作顺序为 (填字母)。
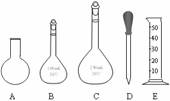
②现需要重复滴定4次,配制0.1 mol/L HCl溶液需要选用下图所示仪器中的
(填字母)。
③经测定,每次消耗NaOH溶液体积的平均值为13.00mL,则该胃药中CaCO3的质量分数 。
④与方案一相比,方案二的主要优点是 。
14.图Ⅰ是NO2(g)+CO(g) CO2(g)+NO(g)反应过程中能量示意图。一定条件下,在固定容积的密闭容器中该反应达到平衡状态。当改变其中一个条件X,Y随X的变化关系曲线如图Ⅱ。
CO2(g)+NO(g)反应过程中能量示意图。一定条件下,在固定容积的密闭容器中该反应达到平衡状态。当改变其中一个条件X,Y随X的变化关系曲线如图Ⅱ。

下列有关说法正确的是 ( )
A.该反应的焓变△H=-234kJ/mol
B.若X表示CO的起始浓度,则Y表示的可能是NO2的转化率
C.若X表示温度,则Y表示的可能是CO2的物质的量浓度
D.若X表示反应时间,则Y表示的可能是混合气体的密度
非选择题(共72分)
13.LiFePO4电池具有稳定性高、安全、对环境友好等优点,可用于电动汽车。电池反应为:
FePO4+Li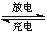 LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,电解质为含Li+的导电固体。下列有关LiFePO4电池说法正确的是 ( )
LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,电解质为含Li+的导电固体。下列有关LiFePO4电池说法正确的是 ( )
A.可加入硫酸以提高电解质的导电性
B.放电时电池内部Li+向负极移动
C.充电过程中,电池正极材料的质量增加
|
12.常温下,下列溶液中有关物质的量浓度关系正确的是 ( )
A.NaHCO3溶液中:c(H+)+c(H2CO3)=c(OH-)+c(CO32-)
B.将稀氨水逐滴加入稀硫酸中,当溶液的pH=7时,c(SO42-)>c(NH4+)
C.物质的量浓度分别为c1和c2的两种醋酸溶液,若其pH分别为a和a+1,则c1=10c2
D.NaA溶液的pH=8,则c(Na+)-c(A-)=9.9×10-7
11.X、Y、Z是三种常见元素的单质,甲、乙是两种常见的化合物,这些单质和化合物之间存在如图所示的转化关系,下列说法正确的是 ( )
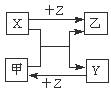
A.X、Y、Z一定是非金属单质
B.X、Y、Z中至少有一种是金属单质
C.若X、Y都为金属单质,则Z必为金属单质
D.若X,Y都为非金属单质,则Z必为金属单质
10.伞形酮可用作荧光指示剂和酸碱指示剂。其合成方法为:
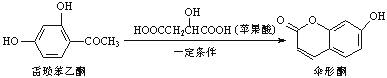
下列有关这三种物质的说法正确的是 ( )
A.每个雷琐苯乙酮、苹果酸和伞形酮分子中均含有1个手性碳原子
B.雷琐苯乙酮和伞形酮都能跟FeCl3溶液发生显色反应
C.1 mol雷琐苯乙酮跟足量H2反应,最多消耗3 mol H2
D.1 mol伞形酮与足量NaOH溶液反应,最多消耗3 mol NaOH
9.下列反应的离子方程式正确的是 ( )
A.澄清石灰水中滴加过量的小苏打溶液:Ca2++OH-+HCO3-=CaCO3↓+H2O
B.铵明矾[NH4Al(SO4)2·12H2O]溶液中加入过量Ba(OH)2溶液:
Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O
C.H2O2溶液中滴加酸性KMnO4溶液:
2 MnO4-+5 H2O2+6H+=2Mn2++5O2↑+8H2O
D.尼泊金酸( )与碳酸氢钠溶液反应:
)与碳酸氢钠溶液反应:
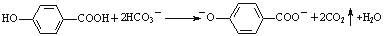
8.天然海水中主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO3-等离子。火力发电燃煤排放的含SO2的烟气可利用海水脱硫,其工艺流程如下图所示:

下列说法错误的是 ( )
A.天然海水pH≈8的原因是由于海水中的CO32-、HCO3-水解
B.“氧化”是利用氧气将H2SO3、HSO3-、SO32-等氧化生成SO42-
C.“反应、稀释”时加天然海水的目的是中和、稀释经氧化后海水中生成的酸
D.“排放”出来的海水中SO42-的物质的量浓度与进入吸收塔的天然海水相同
不定项选择题:本题包括6小题,每小题4分,共24分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确得满分,但只要选错一个,该小题就为0分。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com