
11.下图中甲、乙两个装置用导线连接,有关叙述正确的是 ( )
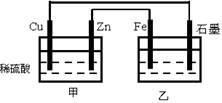
A.甲装置中Cu为阳极,乙装置中Fe为负极
B.甲装置中SO42- 向Cu极移动,乙装置中的Na+ 向石墨极移动
C.乙烧杯中Fe极的电极反应式为:2H++2e-= H2↑
D.当石墨电极上产生11.2L(标准状况)气体时,消耗Zn的质量为65g
10.一定温度下,向质量分数为a、物质的量浓度为c1的乙腈(CH3CN)溶液中加入等体积水,所得溶液中乙腈质量分数为0.4a,物质的量浓度为c2,则乙腈的密度(ρ1)与水的密度(ρ2)及c1、c2的关系是 ( )
A.ρ1>ρ2 c1>2.5c2 B.ρ1>ρ2 c1<2.5c2
C.ρ1<ρ2 c1>2.5c2 D.ρ1<ρ2 c1<2.5c2
9.一定条件下的某密闭容器中,进行如下反应并建立平衡:
2X(g)+Y(g) Z(g)+W(g);△H<0
Z(g)+W(g);△H<0
若改变某一条件,下列说法正确的是 ( )
A.使用催化剂或缩小容器容积,平衡均不发生移动
B.升温既可以提高反应速率又可以提高X的转化率
C.等容时加入少量Z,平衡后混合气体中Z的体积分数变小
D.向容器中加入一定量的Y,上述反应的△H不变
8.下列说法或表示方法中正确的是 ( )
A.氢气的燃烧热为285.8kJ·mol-1,则氢气燃烧的热化学方程式为:
2H2(g)+O2(g)=2H2O(l);△H=-285.8kJ·mol-1
B.已知中和热为57.3 kJ·mol-1,若将1L1mol·L-1的醋酸与含1molNaOH的溶液混合,放出的热量要小于57.3kJ
C.Ba(OH)2·8H2O(s)+2NH4Cl(s)=BaCl2(s)+2NH3(g)+10H2O(l);△H<0
D.等质量的硫蒸气和硫磺分别完全燃烧,后者放出的热量多
7.下列选项中可以用下图表示物质或概念间的从属关系的是 ( )
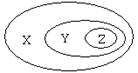
|
|
X |
Y |
Z |
|
A |
化合物 |
离子化合物 |
电解质 |
|
B |
混合物 |
分散系 |
胶体 |
|
C |
元素周期表的纵列 |
主族 |
副族 |
|
D |
烃 |
苯的同系物 |
苯乙烯 |
6.下列关于营养物质的说法正确的是 ( )
A.油脂的氢化属于还原反应,又属于加成反应,生成物为纯净物
B.1mol蔗糖水解生成1mol葡萄糖和1mol果糖
C.淀粉溶液和稀硫酸共热后发生水解反应,冷却后加少量银氨溶液,水浴加热后会出现光亮的银镜
D.鸡蛋白溶液中滴加饱和的硫酸铵溶液,出现白色沉淀,该过程叫蛋白质的变性
21.选做题,共计12分。本题有A、B两题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容,每题12分。请选择其中一题作答,并把所选题目对应字母后的方框涂黑。若两题都作答,将按A题评分。
A.可以由下列反应合成三聚氰胺:
CaO+3C CaC2+CO↑ CaC2+N2
CaC2+CO↑ CaC2+N2 CaCN2+C↑
CaCN2+C↑
CaCN2+2H2O=NH2CN+Ca(OH)2
NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺。
(1)写出与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子的电子排布式: 。CaCN2中阴离子为CN22-,与CN22-互为等电子体的分子有N2O和 (填化学式),由此可以推知CN22-离子的空间构型为 。
(2)尿素分子中C原子采取 杂化。尿素分子的结构简式是 ,其中碳氧原子之间的共价键是 (填字母)
A.2个 键 B.2个
键 B.2个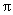 键 C.1个
键 C.1个 键、1个
键、1个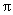 键
键
(3)三聚氰胺( )俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸(
)俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸(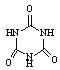 )后,三聚氰酸与三聚氰胺分子相互之间通过 结合,在肾脏内易形成结石。
)后,三聚氰酸与三聚氰胺分子相互之间通过 结合,在肾脏内易形成结石。
(4)CaO晶胞如图所示,CaO晶体中Ca2+的配位数为 。
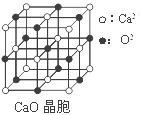
CaO晶体和NaCl晶体的晶格能分别为:CaO 3401kJ/mol、NaCl 786 kJ/mol。导致两者晶格能差异的主要原因是 。
B.实验室用乙酸和正丁醇制备乙酸正丁酯。有关物质的物理性质如下表。请回答有关问题。
|
化合物 |
密度/g·cm-3 |
沸点/℃ |
溶解度/100g水 |
|
正丁醇 |
0.810 |
118.0 |
9 |
|
冰醋酸 |
1.049 |
118.1 |
∞ |
|
乙酸正丁酯 |
0.882 |
126.1 |
0.7 |
Ⅰ.乙酸正丁酯粗产品的制备
在干燥的50mL圆底烧瓶中,装入沸石,加入11.5mL正丁醇和9.4mL冰醋酸,再加3-4滴浓硫酸。然后安装分水器(作用:实验过程中不断分离除去反应生成的水)、温度计及回流冷凝管,加热冷凝回流反应。
(1)本实验过程中可能产生多种有机副产物,写出其中两种的结构简式: 、 。
(2)实验中为了提高乙酸正丁酯的产率,采取的措施是: 、 。
Ⅱ.乙酸正丁酯粗产品的制备
(1)将乙酸正丁酯粗产品用如下的操作进行精制:
①水洗 ②蒸馏 ③用无水MgSO4干燥 ④用10%碳酸钠洗涤,
正确的操作步骤是 (填字母)。
A.①②③④ B.③①④②
C.①④①③② D.④①③②③
(2)将酯层采用如图所示装置蒸馏。

①写出图中仪器A的名称 。冷却水从 口进入(填字母)。
②蒸馏收集乙酸正丁酯产品时,应将温度控制在 左右。
Ⅲ.计算产率
测量分水器内由乙酸与正丁醇反应生成的水体积为1.8 mL,假设在制取乙酸正丁酯过程中反应物和生成物没有损失,且忽略副反应,计算乙酸正丁酯的产率 。
20.(10分)某同学对Cu与HNO3的反应进行如下探究。请回答有关问题。
(1)用下图所示装置制取NO,验证U型管中生成的气体是NO的实验方法是 。

(2)将0.64g Cu全部溶于一定量的浓HNO3中,测得生成气体0.009mol(含NO、NO2和N2O4),共消耗HNO3 0.032 mol。将生成的气体与空气混合,再通入NaOH溶液中,氮氧化物被完全吸收,产物只有NaNO3和H2O。
①计算空气中参加反应的O2在标准状况下的体积为 mL。
②计算0.009 mol 混合气体中N2O4的物质的量(写出计算过程)。
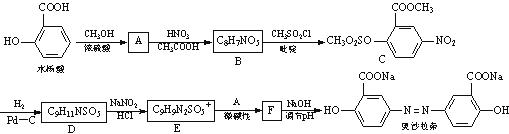
19.(12分)奥沙拉秦是一种抗菌药。其合成路线如下:
已知:①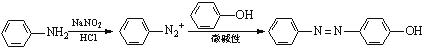
②NaNO2具有强氧化性
(1)写出水杨酸→A反应的化学方程式:
(2)E的结构简式:
(3)从整个合成路线看,设计B→C步骤的作用是:
(4) 也可用于合成奥沙拉秦。它的一种同分异构体X是
也可用于合成奥沙拉秦。它的一种同分异构体X是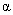 -氨基酸,能与FeCl3发生显色反应,其核磁共振氢谱有6个吸收峰。X的结构简式为
-氨基酸,能与FeCl3发生显色反应,其核磁共振氢谱有6个吸收峰。X的结构简式为
(5)苏丹红1号(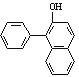 )是一种化工染料。写出以苯和
)是一种化工染料。写出以苯和 -萘酚(
-萘酚(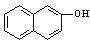 )
)
为原料(其他无机试剂任选),合成苏丹红1号的合成路线。 。
18.(10分)开源节流是应对能源危机的重要举措。
(1)下列做法有助于能源“开源节流”的是 (填字母)。
a.大力开采煤、石油和天然气以满足人们日益增长的能源需求
b.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
c.开发太阳能、水能、风能、地热等新能源、减少使用煤、石油等化石燃料
d.减少资源消耗,增加资源的重复使用、资源的循环再生
(2)氢能是理想的清洁能源。下列制氢的方法中,最节能的是 (填字母)。
a.电解水制氢:2H2O 2H2↑+O2↑
2H2↑+O2↑
b.高温使水分解制氢:2H2O 2H2↑+O2↑
2H2↑+O2↑
c.太阳光催化分解水制氢:2H2O 2H2↑+O2↑
2H2↑+O2↑
d.天然气制氢:CH4+H2O CO+3H2
CO+3H2
(3)利用MnFe2O4通过两步反应使水分解制氢气,第一步反应为:
MnFe2O4 MnFe2O4-X+
MnFe2O4-X+
则第二步反应的化学方程式为 (条件不写)。
(4)下图是以SO2、I2、H2O为原料,利用核能使水分解制氢气的一种流程。

|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com