
27.(15分)某兴趣小组为验证日常生活用的火柴头上含有KClO3、MnO2、S,设计了以下实验流程图:
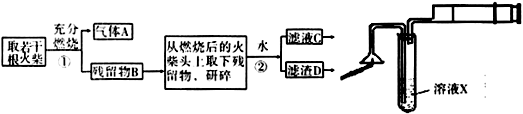
(1)写出步骤①中发生反应的化学方程式
(2)为验证气体A中所含成份,按上图所示进行实验,用于检验A的溶液X是 ,若观察到 现象,即可证明火柴头上含有S。
(3)有学生提出检出火柴头上有KClO3的某套实验方案:
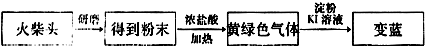
有关的离子方程式为 。有人提出上述方法中出现的现象并不能充分说明火柴头上有KClO3的存在,其理由是 。
(4)该小组猜测滤渣D对双氧水分解制氧气的速率会产生一定的影响,设计进行了以下5次实验。
|
实验序号 |
H2O2溶液质量分数% |
H2O2溶液用量/毫升 |
物质D用量/克 |
反应温度/℃ |
收集气体体积/毫升 |
所需时间/秒 |
|
① |
30 |
5 |
0 |
85 |
2 |
3.8 |
|
② |
15 |
2 |
0.1 |
20 |
2 |
2.8 |
|
③ |
15 |
2 |
0.2 |
20 |
2 |
2.2 |
|
④ |
5 |
2 |
0.1 |
20 |
2 |
7.4 |
|
⑤ |
30 |
5 |
0 |
35 |
2 |
10.5 |
请分析上表数据,可得出什么结论? 。
26.(14分)A、B、C、D、E是中学常见的单质,X是化合物。A为金属原子最外层P轨道上只有一个电子,可与NaOH溶液反应;B是常见的金属,其基态原子的外围电子排布式为3d64s2;常温下C是气态非金属单质,可以燃烧;D是空气主要成份之一,可与C发生重要工业反应生成X;E是固体非金属单质,在氧气中燃烧时有明亮的蓝紫色火焰。根据上述物质的信息,回答下列有关问题:
(1)写出单质B与Cl2的反应产物与X的水溶液反应的离子方程式:
。
B单质在海水中易发生电化学腐蚀,写出该电化学腐蚀的正极电极方程式
。
(2)已知单质E的燃烧热为296.8 kJ/mol,写出表示E燃烧热的热化学方程式 。
(3)写出A的氧化物与NaOH溶液反应的离子方程式 。
(4)将0.40 mol C和0.20 mol D充入2L的密闭容器中,在一定条件反应生成X,有关C、D、X三者的物质的量的变化与时间的关系如下图所示:
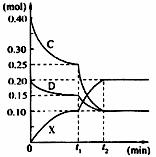
①若t1=10 min,则0至t1时间内C物质的平均反应速率为 ;该反应平衡常数表达式为 。
②该反应在t2时达到平衡,根据图中曲线变化情况判断,t1时刻改变的反应条件可能是 (填下列各项序号)
a.加人了催化剂 b.降低了反应的温度 c.向容器中又充入了气体D
25.(14分)短周期某些元素的性质或原子结构信息如下表所示:
|
A |
B |
C |
D |
|
原子最外层上P电子数等于次外层电子数 |
原子最外层有两个未成对电子,其单质为人类生存必需物质 |
单质为生活中常见的金属材料,有紫红色金属光泽 |
单质是常见的半导体材料,广泛应用于IT行业 |
(1)写出A单质与浓HNO3加热反应的化学方程式 。
(2)写出B元素在周期表中的位置 ,写出C元素基态原子的电子排布式 。
(3)写出A与D的氧化物在高温下反应的化学方程式 。
(4)写出B、D形成的化合物与NaOH溶液反应的离子方程式 。
(5)比较A、B、D三元素原子的第一电离能的大小 (由大到小用元素符号表示)
13.在含有硝酸酮,硝酸铁,硝酸银各0.1 mol的混合溶液中加入铁粉,充分反应后,析出3.29铜,则向溶液中加入的铁粉质量为 ( )
A.5.6g B.2.8g C.14g D.8.4g
第Ⅱ卷(本卷共10题,共180分)
12.对于平衡体系:mA(g) + nB(g) pC(g) + qD(g);△H = -Q kJ/mol (Q > 0),下列判断正确的是 ( )
pC(g) + qD(g);△H = -Q kJ/mol (Q > 0),下列判断正确的是 ( )
A.若温度不变,将容器的体积增大1倍,此时A的浓度变为原来的0.48倍,则m+n>p+q
B.若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n
C.若平衡体系共有气体a mol,再向其中加入b mol B,当重新达到平衡时气体总的物质的量等于(a+b)mol,则m+n>p+q
D.温度不变时,若压强增大至原来的2倍,达到新的平衡时总体积一定比原来的小
11.用NA表示阿伏加德罗常数,下列叙述中正确的是 ( )
A.1 mol CH3+(碳正离子)中含有电子数为10NA
B.l.8 g重水(D2O)中含NA 个中子
C.常温常压下,48 g O3含有的氧原子数为3NA
D.标准状况下,22.4 L甲苯所含的分子数约为6.02×l023
10.燃料电池有广泛的应用前景。下列对乙烷、空气、KOH溶液组成的燃料电池的说法正确的是 ( )
A.通入乙烷的一极是负极,电极反应为:C2H6 + 14e― +4H2O =2CO2 + 14H +
B.该燃料电池工作过程中电解质溶液pH逐渐增大
C.当电路中转移1.4 mol电子时,有标准状况下2.24 L乙烷发生反应
D.OH― 在溶液中向正极移动
9.化学与数学有密切的联系,将某些化学知识用数轴表示,可以收到直观形象、简明易记的良好效果。下列用数轴表示的化学知识中错误的是 ( )
A.分散系的分类

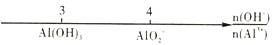
B.AlCl3溶液中滴加NaOH溶液后Al元素的存在形式
C.C与O2燃烧反应的产物
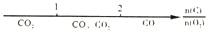
D.Na在空气中加热
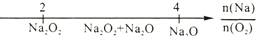
8.下列离子方程式书写正确的是 ( )
A.足量硫酸氢钠溶液与氢氧化钡溶液混合:2H+ + SO2―4+ Ba2+ +2OH― = BaSO4↓+ 2H2O
B.Fe(NO3)3溶液中加入过量的HI溶液:2 Fe3+ + 2I- = 2Fe2+ + I2
C.过量的SO2通入氨水中:SO2 + OH― = HSO―3
D.铁作两电极电解饱和食盐水:2Cl― + 2H2O电解2OH― + H2↑ + Cl2↑
7.2008年北京奥运会主体育场--“鸟巢”,被《泰晤士报》评为全球“最强悍”工程。“鸟巢”运用了高强度、高性能的钒氮合金高新钢和884块ETFE膜,并采用新一代的氮化镓铟高亮度LED材料。有关说法正确的是 ( )
A.合金的熔点通常比组分金属高,硬度比组分金属小
B.已知Ga处于ⅢA族,可推知氮化镓化学式为Ga3N2
C.用金属铝与V2O5冶炼钒,铝作还原剂
D.ETFE膜材料(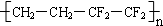 )是纯净物
)是纯净物
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com