
8.设NA为阿伏伽德罗常数,下列叙述正确的是
A.24g镁的原子最外层电子数为NA B.1L0.1mol·L-1乙酸溶液中H+数为0.1NA
C.1mol甲烷分子所含质子数为10NA D.标准状况下,22.4L乙醇的分子数为NA
7.能实现下列物质间直接转化的元素是
单质 氧化物
氧化物 酸或碱
酸或碱 盐
盐
A.硅 B.硫 C.铜 D.铁
6.下列类型的反应,一定发生电子转移的是
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
10.(14分)氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
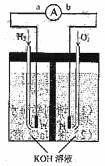
(1)氢氧燃料电池的能量转化主要形式是 ,在导线中电子流动方向为 (用a、b 表示)。
(2)负极反应式为 。
(3)电极表面镀铂粉的原因为
(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一,金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H2 2LiH
2LiH
Ⅱ.LiH+H2O==LiOH+H2↑
①反应Ⅰ中的还原剂是 ,反应Ⅱ中的氧化剂是 。
②已知LiH固体密度为0.82g/cm3。用锂吸收224L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为 。
③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为 mol。
9.(18分)海水是巨大的资源宝库,在海水淡化及综合利用方面,天津市位居全国前列;从海水中提取食盐和溴的过程如下:
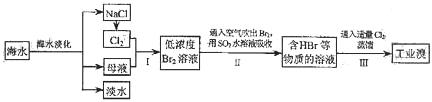
(1)请列举海水淡化的两种方法: 、 。
(2)将NaCl溶液进行电解,在电解槽中可直接得到的产品有H2、 、 、或H2、 。
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的为 。
(4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为 ,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是 。
(5)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃。微溶于水,有毒性和强腐蚀性。他们参观生产过程后,绘制了如下装置简图:
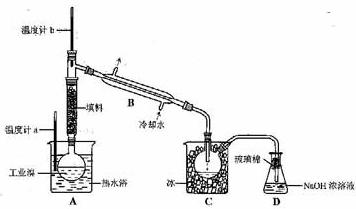
请你参与分析讨论:
①图中仪器B的名称: 。
②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是 。
③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件: 。
④C中液体产生颜色为 。为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是 。
6.已知:2CO(g)+O2(g)===2CO2(g) 
Na2O2(s)+CO2(g)=Na2CO3(s)+  ΔH=-226 kJ/mol
ΔH=-226 kJ/mol
根据以上热化学方程式判断,下列说法正确的是
A.CO的燃烧热为283 kJ
B.下图可表示为CO生成CO2的反应过程和能量关系
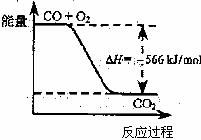
C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(s) ΔH>-452kJ/mol
D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
第Ⅱ卷
(14分)下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
|
族 周期 |
IA |
|
0 |
|||||
|
1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
|
2 |
|
|
|
② |
③ |
④ |
|
|
|
3 |
⑤ |
|
⑥ |
⑦ |
|
|
⑧ |
|
(1)④、⑤、⑥的原子半径由大到小的顺序为_________________________。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是_________________________。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:____________________。
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)_________________。
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
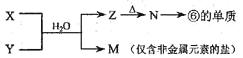
X溶液与Y溶液反应的离子方程式为_____________________,
N→⑥的单质的化学方程式为________________。
常温下,为使0.1 mol/L M 溶液中由M电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至_________________。
5.人体血液内的血红蛋白(Hb)易与O2结合生成HbO2,因此具有输氧能力,CO吸入肺中发生反应:CO+HbO2 O2+HbCO,37℃时,该反应的平衡常数K=220.HbCO的浓度达到HbO2浓液的0.02倍,导使人智力受损。据此,下列结论错误的是
O2+HbCO,37℃时,该反应的平衡常数K=220.HbCO的浓度达到HbO2浓液的0.02倍,导使人智力受损。据此,下列结论错误的是
A.CO与HbO2反应的平衡常数K=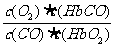
B.人体吸入的CO越多,与血红蛋白结合的O2越少
C.当吸入的CO与O2浓度之比大于或等于0.02时,人的智力才会受损
D.把CO中毒的病人放入高压氧仓中解毒,其原理是使上述平衡向左移动
4.下列叙述正确的是
A.0.1 mol/L C6H5ONa溶液中:c(Na+)>c(C6H5O-)>c(H+)>c(OH-)
B.Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小
C.pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)不相等
D.在Na2S溶液中加入AgCl固体,溶液中c(S2-)下降
3.下列实验设计和结论相等的是
A.将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中
B.某气体能使湿润的红色石蕊试纸变蓝,该气体水溶液一定显碱性
C.某无色溶液中加Ba(NO2)2溶液,再加入稀盐酸,沉淀不溶解,则原溶液中一定有SO42-
D.在含FeCl2杂质的FeCl3溶液中通足量Cl2后,充分加热,除去过量的Cl2,即可得到较纯净的FeCl3溶液
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com