
9.已知

 有相同容积的定容密封容器甲和乙,甲中加入
有相同容积的定容密封容器甲和乙,甲中加入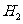 和
和 各0.1mol,乙中加入HI
0.2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是
各0.1mol,乙中加入HI
0.2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是
A.甲、乙提高相同温度 B.甲中加入0.1mol He,乙不变
C.甲降低温度,乙不变 D.甲增加0.1mol 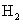 ,乙增加0.1mol
,乙增加0.1mol
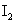
8.下列叙述正确的是
A.将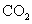 通入
通入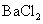 溶液中至饱和,无沉淀产生;再通入
溶液中至饱和,无沉淀产生;再通入 ,产生沉淀
,产生沉淀
B.在稀硫酸中加入铜粉,铜粉不溶解;再加入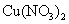 固体,铜粉仍不溶解
固体,铜粉仍不溶解
C.向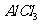 溶液中滴加氨水,产生白色沉淀;再加入
溶液中滴加氨水,产生白色沉淀;再加入 溶液,沉淀消失
溶液,沉淀消失
D.纯锌与稀硫酸反应产生氨气的速率较慢;再加入少量 固体,速率不改变
固体,速率不改变
7.W、X、Y、Z均为短周期元素,W的最外层电子数与核外电子总数之比为7:17;X与W同主族;Y的原子序数是W和X的原子序数之和的一半;含Z元素的物质焰色反应为黄色。下列判断正确的是
A.金属性:Y Z
B.氢化物的沸点:
Z
B.氢化物的沸点: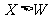
C.离子的还原性: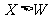 D.原子及离子半径:
D.原子及离子半径:
6.下列叙述不正确的是
A.铁表面镀锌,铁作阳极
B.船底镶嵌锌块,锌作负极,以防船体被腐蚀
C.钢铁吸氧腐蚀的正极反应:
D.工业上电解饱和食盐水的阳极反应:
5.化学与人类生活密切相关。下列说法正确的是:
A.苯酚有一定毒性,不能作消毒剂和防腐剂
B.白磷着火点高且无毒,可用于制造安全火柴
C.油脂皂化生成的高级脂肪酸钠是肥皂的有效成分
D.用食醋去除水壶中的水垢时所发生的是水解反应
28.(17分)
Fenton法常用于处理含难降解的有机物的工业废水,通常是在调节好pH和 浓度的废水中加入
浓度的废水中加入 所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物
所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物 ,探究有关因素对该降解反应速率的影响。
,探究有关因素对该降解反应速率的影响。
[实验设计]控制 的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表)。设计如下对比实验。
的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表)。设计如下对比实验。
(1)请完成以下实验设计表(表中不要留空格)。
|
实验 编号 |
实验目的 |
T/K |
pH |
 |
|
 |
 |
||||
|
① |
为以下实验作参照 |
298 |
3 |
6.0 |
0.30 |
|
② |
探究温度对降解 反应速率的影响 |
|
|
|
|
|
③ |
|
298 |
10 |
6.0 |
0.30 |
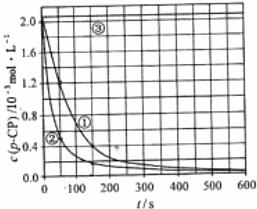
[数据处理]实验测得 的浓度随时间变化的关系如上图。
的浓度随时间变化的关系如上图。
(2)请根据上图实验①曲线,计算降解反应在50-150 内的反应速率;
内的反应速率;


[解释与结论]
(3)实验①②表明温度升高,降解反应速率增大。但温度过高时反而导致降解反应速率减小,请从Fenton法所使用试剂 的角度分析原因:
的角度分析原因:
(4)实验③得出的结论是: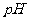 =10时,
=10时,
[思考与交流]
(5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来,根据上图中信息,给出一种迅速停止反应的方法:
27.(12分)
某工厂废水中含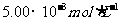 的
的 ,其对毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料
,其对毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料 (
( 的化合价依次为+3、+2),设计了如下实验:
的化合价依次为+3、+2),设计了如下实验:
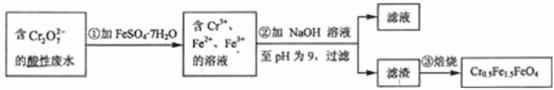
(1)第1步反应的离子方程式是 。
(2)第2步中用pH试纸测定溶液pH的操作是 。
(3)第2步过滤的滤杂中的成分除 ,还有
。
,还有
。
(4)欲使1L该废水中的 完全转化为
完全转化为 ,理论上需要加入 g
,理论上需要加入 g 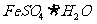 。
。
26.(12分)
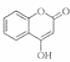 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:

(1)A 与银氨溶液反应有银镜生成,则A的结构简式是
(2)B-C的反应类型是
(3)E的结构简式是
(4)写出F和过量NaOH溶液共热时反应的化学方程式:
(5)下列关于G的说法正确的是
a.能于溴单质反应 b.能与金属钠反应
c.1 G最多能和3
G最多能和3 氢气反应 d.分子式是
氢气反应 d.分子式是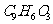
25.(17分)
W、X、Y、Z是周期表前36号元素中的四种常见元素,其原子系数依次增大。W、Y的氧化物是导致酸雨的主要物质,X的基态原子核外有个原子轨道填充了电子,Z能形成红丝(或砖红色)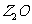 和黑色的
和黑色的 两种氧化物。
两种氧化物。
(1)W位于元素周期表第_________周期第__________族。W的气态氢化物稳定性比H2O(g)_________(填“强”或“弱”)。
(2)Y的基态原子核外电子排布是__________,Y的第一电离能比X的_________(填“大”或“小”)
(3)Y的最高价氧化物对应水化物的浓溶液与Z的单质反应的化学方程式是
________________________________________________________________________。
(4)已知下列数据:


X的单质和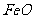 反应的热化学方程式是____________________________。
反应的热化学方程式是____________________________。
13.向体积Va的0.05mol·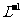 C
C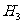 COOH溶液中加入体积为Vb的0.05mol·
COOH溶液中加入体积为Vb的0.05mol·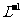 KOH溶液,下列关系错误的是
KOH溶液,下列关系错误的是
A.Va>Vb时:c(C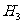 COOH)+c(C
COOH)+c(C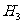 CO
CO )>c(
)>c(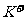 )
)
B.Va=Vb时:c(C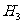 COOH)+ c(
COOH)+ c(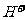 )=c(O
)=c(O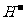 )
)
C.Va<Vb时:c(C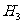 CO
CO )>c(
)>c(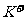 )>c(O
)>c(O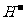 )>c(
)>c(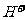 )
)
D.Va与Vb任意比时:c(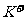 )+ c(
)+ c(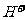 )= c(O
)= c(O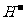 )+ c(C
)+ c(C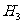 CO
CO )
)
第II卷(非选择题 共180分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com