
10.硫代硫酸钠溶液与稀硫酸反应的化学方程式为:
Na2S2O3+H2SO4== Na2SO4+SO2+S↓+H2O,下列各组实验中最先出现浑浊的是
|
实验 |
反应温度/℃ |
Na2S2O3溶液 |
稀H2SO4 |
H2O |
||
|
V/mL |
c/(mol·L-1) |
V/mL |
c/(mol·) |
V/mL |
||
|
A |
25 |
5 |
0.1 |
10 |
0.1 |
5 |
|
B |
25 |
5 |
0.2 |
5 |
0.2 |
10 |
|
C |
35 |
5 |
0.1 |
10 |
0.1 |
5 |
|
D |
35 |
5 |
0.2 |
5 |
0.2 |
10 |
9.下列化合物中既能使溴的四氯化碳溶液褪色,又能在光照下与溴发生取代反应的是
A.甲苯 B.乙醇 C.丙烯 D.乙烯
8.3-甲基戊烷的一氯代产物有(不考虑立体异构)
A.3种 B.4种 C.5种 D.6种
7.将22.4 L某气态氮氧化合物与足量的灼热铜粉完全反应后,气体体积变为11.2 L(体积均在相同条件下测定),则该氮氧经合物的化学式为
A.NO2 B.N2O3 C.N2O D.N2O4
(二)选考题:共45分。请考生从给出的4道物理题、3道化学题、2道生物题中每科任选一题做答,并用2B铅笔在答题卡上把所选题目的题号涂黑。注意所做题目的题号必须与所涂题目的题号一致,在答题卡选答区域指定位置答则每学科按所做的第一题计分。
37.[化学-化学选修化学与技术](15分)
请回答氯碱工业中的如下问题:
(1)氯气、烧碱是电解食盐水时按照固定的比率k(质量比)生成的产品。理论上k=
(要求计算表达式和结果);
(2)原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、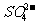 等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)③BaCl2,这3种试剂添加的合理顺序是
。(填序号)
等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)③BaCl2,这3种试剂添加的合理顺序是
。(填序号)
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
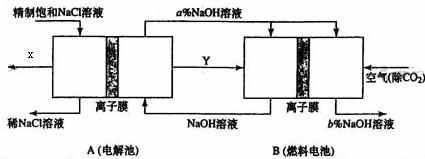
①图中X、Y分别是 、 (填化学式),分析比较图示中氢氧化钠质量分数a%与b%的大小
②分别写燃烧电池B中正极、负极上发生的电极反应
正极: ;负极 ;
③这样设计的主要节(电)能之处在于(写出2处) 、 。
38.[化学-选修物质结构与性质](15分)
已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素原子基态时的电子排布式为 ,该元素的符号是
(2)Y元素原子的价层电子的轨道表示式为 ,该元素的名称
(3)X与Z可形成化合物XZ3,该化合物的空构型为
(4)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是
(5)比较X的氯化物与同族第二、三周期元素所形成的氢化物稳定性、沸点高低并说明理由
39.[化学-选修有机化学基础](15分)
A-J均为有机化合物,它们之间的转化如下图所示:
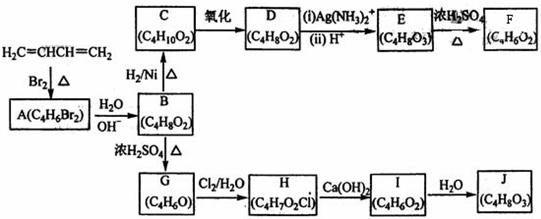
实验证明:
①D既能发生银镜反应,又能与金属钠反应放出氢气;
②核磁共振氢谱表明F分子中有三种氢,且其峰面积之比为1:1;
③G能使溴的四氯化碳溶液褪色;
④1mol J与足量金属钠反应可放出22.4L 氢气(标准状况)。
请根据以上信息回答下列问题:
(1)A的结构简式为__________________(不考虑立体导构),由A生成B的反应类型是_______________反应;
(2)D的结构简式为_____________________;
(3)由E生成F的化学方程式为________,E中的官能团有________(填名称),与E具体有相同官能团的E的同分异构体还有__________________(写出结构简式,不考虑立体导构);
(4)G的结构简式为_______________________;
(5)由I生成J的化学方程式为_______________________。
(一) 必考题(11题,共129分)
26.(14分)
碱式碳酸铜可表示为:xCuCO3·y Cu(OH)2·zH2O,测定碱式碳酸铜组成的方法有多种。
(1)现采用氢气还原法,请回答如下问题:
①写出xCuCO3·y Cu(OH)2·2H2O与氢气反应的化学方程式___________。
②实验装置用下列所有仪器连接而成,按氢气流方向的连接顺序是(填入仪器接口字母编号):
(a)→( )( )→( )( )→( )( )→( )( )→( )( )→(l)
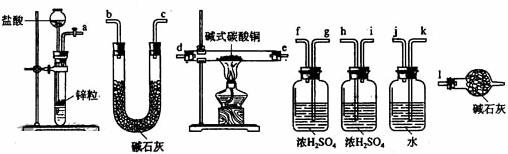
③称取23.9 g某碱式碳酸铜样品,充分反应后得到12.7 g残留物,生成4.4 g二氧化碳和7.2 g水。该样品的结晶水质量为________g,化学式为_____________________;
(2)某同学以氮气代替氢气,并用上述全部或部分仪器来测定碱式碳认为是否可行?请说明理由。________________________________________________________________
27.(15分)
下图表示有关物质(均出短周期元素形成)之间的转化关系,其中A为常见的金属单质、B为非金属单质(一般是黑色粉末),C是常见的无色无味液体,D是淡黄色的固体化合物。(反应条件图中已省略。)
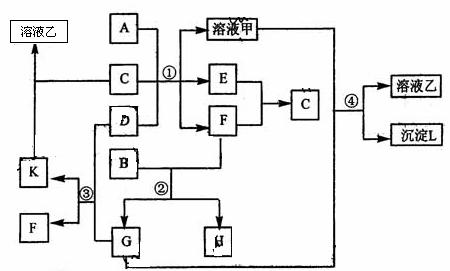
(1)A、B、C、D代表的物质分别为 、 、 、 (填化学式);
(2)反应①中的C、D均过量,该反应的化学方程式是 ;
(3)反应②中,若B与F物质的量之比为4:3,G、H分别是 、 (填化学式);
(4)反应③产物中K的化学式为 ;
(5)反应④的离子方程式为 。
28.(14分)
2SO2(g)+O2(g) 2SO3(g)反应过程的能量变化如图所示。已知1molSO2(g)氧化为1mol SO3(g)的
2SO3(g)反应过程的能量变化如图所示。已知1molSO2(g)氧化为1mol SO3(g)的 H=-99kJ·mol-1。
H=-99kJ·mol-1。
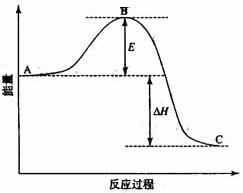
请回答下列问题:
(1)图中A、C分别表示 、 ,E的大小对该反应热有无影响? 。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? ,理由是 ;
(2)图中 H= kJ·mol-1;
H= kJ·mol-1;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式 ;
(4)如果反应速率v(SO2)为0.05 mol·L-1·min-1,则v(O2)= mol·L-1·min-1、
v(SO3)= mol·L-1·min-1.
(5)已知单质硫的燃烧热为296kJ·mol-1,计算由S(s)生成3molSO3(g)的 H
H
(要求计算过程)。
13.在一定温度下,反应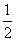 H2(g)+
H2(g)+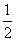 X2(g)
X2(g) HX(g)的平衡常数为10。若将1.0 mol的HX(g)通入体积为1.0 L的密闭容器中,在该温度时HX(g)的最大分解率接近于
HX(g)的平衡常数为10。若将1.0 mol的HX(g)通入体积为1.0 L的密闭容器中,在该温度时HX(g)的最大分解率接近于
A.5% B.17% C.25% D.23%
第Ⅱ卷
12.能正确表示下列反应的离子方程式是
A.向次氯酸钙溶液通入过量CO2:Ca2++2ClO-+H2O+CO2=CaCO3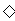 +2HClO
+2HClO
B.向次氯酸钙溶液通入SO2:Ca2++2ClO-+H2O+SO2=CaSO3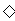 +2HClO
+2HClO
C.氢氧化钙溶液与碳酸氢镁溶液反应:Ca2++OH-+HCO-3=CaCO3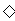 +H2O
+H2O
D.在氢化亚铁溶液中加入稀硝酸:3Fe2++4H++NO-3=3Fe3++2H2O+NO
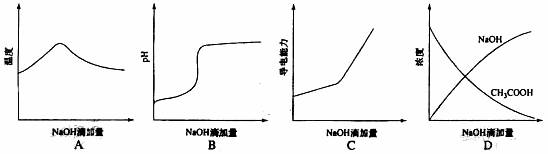
11.将氢氧化钠稀溶液滴加到醋酸稀溶液中,下列各图示意混合溶液有关量或性质的变化趋势,其中错误的是
10.硫代硫酸钠溶液与稀硫酸反应的化学方程式为:
Na2S2O3+H2SO4== Na2SO4+SO2+S↓+H2O,下列各组实验中最先出现浑浊的是
|
实验 |
反应温度/℃ |
Na2S2O3溶液 |
稀H2SO4 |
H2O |
||
|
V/mL |
c/(mol·L-1) |
V/mL |
c/(mol·) |
V/mL |
||
|
A |
25 |
5 |
0.1 |
10 |
0.1 |
5 |
|
B |
25 |
5 |
0.2 |
5 |
0.2 |
10 |
|
C |
35 |
5 |
0.1 |
10 |
0.1 |
5 |
|
D |
35 |
5 |
0.2 |
5 |
0.2 |
10 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com