
8.下列各组离子在给定条件下能大量共存的是 ( )
A.含有大量ClO-的溶液:SO42-、NH4+、Na+、H+
B.c(H+)>c(OH-)的溶液:K+、AlO2-、HCO3-、Na+、
C.含有大量SO42-的溶液:C6H5O-、OH-、NO3-、K+
D.含有大量Fe3+的溶液:Na+、Mg2+、Cl-、SCN-
7.下列叙述正确的是(NA表示阿伏加德罗常数值) ( )
A.1 mol C60F60分子中碳原子之间共用电子对数为90NA
B.2.1 g DTO分子中所含中子数为NA
C.等质量的O2与O3所占体积之比一定为3:2
D.某纯净物Mg完全溶解在Ng水中,所得溶液的溶质质量分数一定为
6.下列选项的两个量中,前者一定大于后者的是 ( )
A.F2和Br2的沸点
B.耐火材料CaO和MgO的熔点
C.25℃时,等体积、pH均等于3的盐酸和A1C13溶液中,已电离的水分子数
D.H-和H+的离子半径
29.(16分)某有机化合物A能发生如下图所示转化:
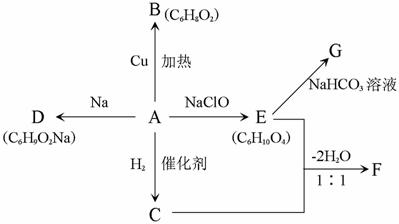
已知:
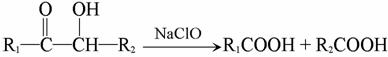
且E分子中没有支链。
请回答:
(1)A的分子式为: ;C和E中含有的官能团的名称分别为: 。
(2)F的结构简式为: ;
(3)反应E+C→F的反应类型为: ;在A→B的反应中,Cu的作用为: 。
(4)反应A→D的方程式为: ;
反应E→G的方程式为: 。
28.(14分)硫酸亚铁铵又名摩尔盐是一种复盐,常以水合物[FeSO4·(NH4)2SO4·6H2O]形式存在,为浅蓝绿色晶体,在空气中比一般亚铁盐稳定,是分析化学中常用的还原剂。
实验室可用如下方法来制备硫酸亚铁铵:
①称取12.4g(NH4)2SO4加入到FeSO4溶液中,加热蒸发浓缩;
②称取5.6g废铁屑投入到20mL5%的Na2CO3溶液中,煮沸几分钟后过滤并用蒸馏水洗净;
③把洗净的铁粉加入到60mL 2mol/L的H2SO4溶液中,小火加热温度控制在50℃~60℃之间,并不断补充蒸馏水以保持原体积,直至不再有气泡放出;
④趁热过滤,滤液转移到蒸发皿中;
⑤冷却至室温过滤得产品;
已知:FeSO4·7H2O在冷水中溶解度很小。
试回答下列问题:
(1)正确的实验步骤为 ;
(2)步骤②中用Na2CO3溶液煮沸几分钟的目的是: ;
步骤③为何不利用大火加热来提高反应速率? 。
(3)步骤④为什么要趁热过滤? 。
(4)摩尔盐品质的高低主要决定于Fe2+及Fe3+的含量,用上述方法制备的硫酸亚铁铵中往往含有Fe3+,若要检验其中是否含有Fe3+,可以使用哪种试剂:
A.NaOH溶液 B.KSCN溶液 C.苯酚溶液 D.石蕊试液
(5)取3.92g硫酸亚铁铵晶体配成100mL溶液,用酸式滴定管取20.00mL注入锥形瓶中,然后用未知浓度的酸性高锰酸钾溶液进行滴定,消耗该溶液的体积为8.00mL。
①配平下列反应式:
Fe2++ MnO4-+ H+ - Mn2++ Fe3++ H2O
②用 (酸式或碱式)滴定管盛装高锰酸钾溶液
③高锰酸钾溶液的物质的量浓度是 。
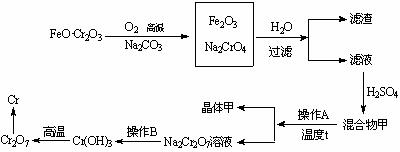
27.(15分)铬元素及其化合物在现代工业中用途十分广泛。某科研小组在探究铬及其化合物性质时得到如下的资料信息:
Ⅰ 铬元素在自然界中主要以铬铁矿(FeO•Cr2O3)形式存在
Ⅱ Cr的常见化合价:+2,+3,+6
Ⅲ 这种元素以不同化合物的形式存在时颜色不同(见下表),故被称为“多彩的元素”
|
微粒 |
Cr(OH)3 |
CrO2- |
Na2CrO4 |
Cr3+ |
Ag2CrO4 |
Cr2O72- |
BaCrO4 |
|
颜色 |
灰绿色 |
绿色 |
黄色 |
紫色 |
砖红色 |
橙色 |
柠橙黄色 |
Ⅳ 工业上冶炼铬的流程如下:
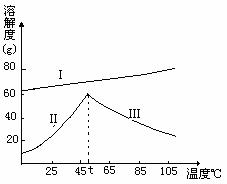
Ⅴ 铬酸钠及硫酸钠的溶解度曲线如图:
(I:Na2Cr2O7•2H2O II:Na2SO4•10H2O III:Na2SO4)
完成下列各题:
(1)由Cr2O3→Cr可用铝热法,反应的方程式为 。
(2)向BaCrO4浊液中滴加Ag+试剂,混合物的颜色逐渐转化为砖红色,说明Ag2CrO4 的溶解度 ( 填“大于”或“小于”)BaCrO4的溶解度。
(3)依据以上信息分析,下列说法正确的是 。
A.操作B过程中一定加入还原剂
B.铬的化合物可以做某种指示剂
C.若晶体甲为Na2SO4,则操作A是继续蒸发结晶,趁热过滤
D.若晶体甲为Na2SO4•10H2O,则操作A是继续蒸发结晶,趁热过滤
(4)Cr(OH)3的性质与Al(OH)3的性质相似,完成Cr(OH)3在水中的电离方程式:
。
若向Cr(OH)3的浊液中逐滴滴加NaOH溶液,观察到的实验现象是: 。
若继续向所得的溶液中滴加H2O2,溶液逐渐变成黄色,该变化的离子反应方程式:
。
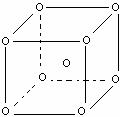
(5)铬晶体基本结构单元如图(铬原子分布在立方体的顶点和体心):若金属铬的密度为ρg/cm3,铬的相对原子质量为M,NA代表阿伏加德罗常数,则晶胞的边长a为: 。
26.(15分)
(1)由第一、第二周期元素组成的几种物质,其组成分别如下:
A:H2O2 B:NH2OH(羟胺) C:HO-CN(氰酸)
D:H2N-NH2(肼) E:H2N-CN(氰胺)
回答下列问题:
①具有18电子的分子有: (用字母表示)
②从结构上看,羟胺是氨分子中的一个氢原子被羟基取代的产物,羟胺的电子式为:
。
③H2在空气中燃烧控制适当的条件可以生成H2O2,且H2(g)+O2(g)=H2O2(l);ΔH= kJ/mol。若H2的燃烧热是285.8kJ/mol,完成H2O(l)生成H2O2(l)的热化学方程式:
。
kJ/mol。若H2的燃烧热是285.8kJ/mol,完成H2O(l)生成H2O2(l)的热化学方程式:
。
(2)将8mol H2和2molN2充入2L密闭容器中,在一定条件下进行合成氨反应,4min后反应达到平衡,测得容器中还有5.6molH2。则用N2表示的反应速率为 。
当其他条件不变,将容器体积变为1L达到新平衡时,N2的浓度 (填“>”、“=”、“<”“=”原平衡时N2的浓度。
(3)用两支惰性电极插入500mL pH为6.0的AgNO3溶液中,通电电解,当电极上析出固体质量大约为54mg时,电解液的pH约为 (设电解时阴极没有氢气析出,且电解液在电解前后体积变化可以忽略),阳极电板反应式为 。
13.室温时,0.1 mol·L-1的HA 溶液的pH=3,向该溶液中逐滴加入NaOH溶液,在滴加过程中,有关叙述不正确的是 ( )
A.未加入NaOH溶液时,原HA溶液中,C(H+) = C(OH-) + C(A-)
B.向原溶液中滴入少量的0.1 mol·L-1的NaOH 溶液,可促进HA的电离,且原溶液的pH升高。
C.当滴入的NaOH与HA恰好完全中和时,溶液中C(Na+) = C(A-),且溶液呈中性。
D.当加入过量的NaOH溶液时,溶液中离子浓度可能为:C(Na+)>C(A-)>C(OH-)>C(H+)
第Ⅱ卷(174分)
12.由一个氧原子,一个氮原子,7个氢原子和若干个碳原子组成的有机物分子,其碳原子的个数最少为 ( )
A.1 B.2 C.3 D.4
11.下列说法正确的是 ( )
A.常见金属铁和铝在工业上是由热还原法制得的
B. 和
和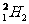 的物理性质略有差异,化学性质几乎完全相同
的物理性质略有差异,化学性质几乎完全相同
C.实验室中用棕色滴瓶存放溴水
D.雾、有色玻璃、葡萄糖溶液中分散质的粒子直径大小均在1nm-100nm之间
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com