
9.下列说法一定正确的是 ( )
A.晶体熔化时,都仅发生物理变化
B.若

C.溶液的pH变小,其酸性必定增强
D.原子晶体中各相邻原子间都以共价键相结合
|
A.其同系物中相对分子质量最小的是

B.其分子中所有碳原子共面
C.若与醇反应得到碳、氢原子个数比为9:l0的酯,则该醇一定是乙醇
D.其钠盐可用作奶粉中的抗氧化剂
8.下列实验中,所加物质的浓度不会影响实验现象的是 ( )
A.向Fe(OH) 胶体中滴加HCl,先出现沉淀,后沉淀溶解
胶体中滴加HCl,先出现沉淀,后沉淀溶解
B.向少量苯酚溶液中滴入溴水,有白色沉淀产生
C.向盛有少量 的烧瓶中加入盐酸,加热,有黄绿色气体产生
的烧瓶中加入盐酸,加热,有黄绿色气体产生
D.向盛有少量铜片的试管中加入 ,加热,有气体放出
,加热,有气体放出
7.反应I与Ⅱ分别是从海藻灰和智利硝石中提取碘的主要反应
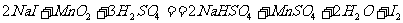 (Ⅰ)
(Ⅰ)
 (Ⅱ)
(Ⅱ)
下列分析正确的是 ( )
( )
A.随着反应的进行,反应I与Ⅱ的溶液酸性均增强
B.氧化性:

C.反应II随着反应的进行,速率加快
D.反应I与II生成等量I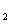 时转移的电子数为1:1
时转移的电子数为1:1
6.生活中有很多化学问题。下列判断正确的是 ( )
A.医疗上,碳酸氢钠是治疗胃穿孔的一种药剂
B.可乐饮料中含有的兴奋性物质咖啡因(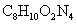 )属于有机物
)属于有机物
C.食品工业中的分离膜是一种新型无机非金属材料
D.日常食用的冰糖、麦芽糖都属于单糖
29.(15分)已知

甲苯及其卤代物是有机化工的基本原料,由它出发可制造某些香料、药物及广泛应用于印刷、电子工业中的感光树脂(不饱合酯)的重要中间体,它们之间的关系如图所示:

D可以在一定条件下与乙炔作用形成一种优质高分子感光树脂。试回答:
(1)B中所含有的官能团的名称为: 。
(2)G的结构简式: 。
(3)反应(I)的类型是 。
(4)C有许多芳香族同分异构体,其中能够发生消去反应的同分异构体(不含C)共有
种。
(5)D→H的总反应方程式: 。
28.(15分)下图是一些常见元素的单质或化合物之间的转化关系,已知A、C、D、F、G、M、N均为氧化物,B、E、H、I、L均为非金属单质,其中D、G、H、I、J、L、M、N在常温下为气态。已知A为光导纤维的成分,F、K的焰色反应为黄色。反应①是工业制粗硅的反应,反应③是呼吸面具和潜水艇里氧气来源的反应(图中某些生成物已略去)。
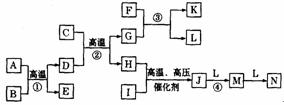
(1)J的结构式为 ,G的电子式 。
(2)④的化学方程式: 。
(3)25°C、101kPa时,已知2.2gG发生反应③放出的热量为akJ,写出的反应③的热化学方程式: 。
(4)在高温下,C和D反应生成G和H是一个可逆反应,甲容器为一恒容容器,乙为一恒压容器,两容器均保持恒温,各充入2molC和1molD,反应前容器的体积相等,反应达平衡后,测得甲容器C的转化率为30%,则乙容器达平衡时G的物质的量为 ,甲、乙两容器中,H的物质的量的浓度,甲 乙(填“大于”、“等于”或“小于”)。
27.(15分)有些化学反应进行时观察不到明显的现象。某兴趣小组为证明NaOH溶液与稀盐酸发生了中和反应,从不同角度设计了如下方案。
方案一:先用pH试纸测定NaOH溶液的pH,再滴加盐酸并不断振荡,同时测定混合溶液的pH,试液逐渐变小且小于7,证明NaOH与稀盐酸发生了中和反应。
(1)用pH试纸测定溶液的pH时,正确的操作是:
方案二:在NaOH溶液中滴加几滴酚酞,溶液显红色,再滴加稀盐酸,红色逐渐消失,证明NaOH溶液与稀盐酸发生了中和反应。但该组同学在向NaOH溶液中滴加酚酞试液时发现氢氧化钠溶液中滴入酚酞试液后,溶液变成了红色,过了一会儿红色消失。该小组对这种意外现象的原因作如下猜想:
①可能是酚酞被空气中的氧气氧化,使红色消失;
②可能是氢氧化钠溶液与空气中的二氧化碳反应,使红色消失。
|
(3)为验证猜想②,取一定量的Na2CO3溶液,向其中滴入酚酞试液,发现溶液呈现红色,得出以下结论:
结论1:Na2CO3溶液呈 性;其原因是(用离子方程式表示)
结论2:溶液红色消失与空气中的二氧化碳无关。
(4)通过查阅资料得知:酚酞在氢氧化钠溶液浓度很大时,可能重新褪至无色。请设计实验方案证明红色消失的原因是取用的NaOH溶液的浓度过大。
实验方法:
观察到的现象:
26.(15分)
I.下表是元素周期表的一部分,请从下①~⑩十种元素中选择适当的元素回答下列问题:
|
族 周期 |
I A |
II A |
III A |
IV A |
V A |
VI A |
VII A |
|
1 |
① |
|
|||||
|
2 |
② |
③ |
④ |
|
⑤ |
⑥ |
|
|
3 |
|
⑦ |
⑧ |
|
|
⑨ |
⑩ |
(1)写出元素⑩的+1价含氧酸的结构式:
(2)写出元素⑧的单质与NaOH溶液反应的离子方程式:
(3)元素⑨形成的单质中存在的化学键为_________________;
(4)物质熔沸点的高低与该物质的晶体结构有关。④的单质晶体熔点为2573K,沸点3895K,硬度大,则属于 晶体。某同学猜想⑧和⑩形成的化合物B晶体类型与NaCl相同,现用实验证明上述猜想是否正确,你的实验方案是 :
。
II.硅--无机非金属材料的主角。未来的交通工具将采用新一代无机非金属材料制成的无水冷发动机。这类材料中研究得较多的化合物G。
(5)化合物G的相对分子质量为140,G为氮和硅两种元素组成的化合物,其中硅元素的质量分数为60%。
①化合物G的化学式为 ,②粉末状G可以由四氯化硅的蒸气与NH3在高温条件下反应生成,同时产生HCl气体。写出其化学反应方程式:
2.答卷前将答题纸密封线内的项目填写清楚。
1.用钢笔或圆珠笔直接答在试题卷中
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com