
12.化合物A、B、C、D各由两种元素组成,甲、乙、丙是三种单质。这些常见的化合物与单质之间存在如下关系(已知化合物C是最简单的一种烃),以下结论不正确的是( )
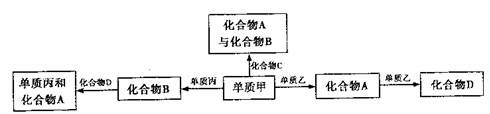
A.上图转化关系所涉及的化合物中有两种是电解质
B.上图所示的五个转化关系中,有三个是化合反应
C.上述转换关系所涉及的化合物有三种属于氧化物
D.上图所示反应均为氧化还原反应
11.某容器中发生一个化学反应,反应过程中存在As2S3、HNO3、H2SO4、NO、H3AsO4、H2O六种物质,已知As2S3是反应物之一。下列有关判断不正确的是 ( )
A.该容器中发生了氧化还原反应
B.该反应中HNO3、H2O等物质是反应物,H2SO4、NO、H3AsO4是生成物
C.HNO3、H2SO4、H3AsO4都属于最高价氧化物的水化物
D.该反应中只有砷元素被氧化、只有氮元素被还原
10.下列叙述正确的是 ( )
A.物质的量浓度相等的 H2S 和 NaHS 混合溶液中:
c (Na+) +c(H+) = c (S2―) +c (HS‑)+c (OH―)
B.相同物质的量浓度的下列溶液中,①NH4Al(SO4)2、②NH4Cl、③CH3COONH4、④NH3·H2O; c(NH4+) 由大到小的顺序是:①>②>③>④
C.某二元酸(H2A)在水中的电离方程式是:H2A H++HA-,HA-  H++A2-;则在NaHA溶液中:c(Na+) = c(A2-)+c(HA-)+c(H2A)
H++A2-;则在NaHA溶液中:c(Na+) = c(A2-)+c(HA-)+c(H2A)
D.pH=12氨水溶液与pH=2盐酸溶液等体积混合 c(Cl-)>c(NH4+)>c(H+)>c(OH-)
9.已知可逆反应aA+Bb  cC中,物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是 ( )
cC中,物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是 ( )
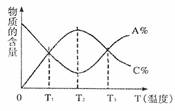
A.该反应在T1、T3温度时达到过化学平衡
B.该反应的逆反应是放热反应
C.该反应在T2温度时达到过化学平衡
D.升高温度,平衡会向正反应方向移动
8.设NA表示阿伏加德罗常数,下列说法中正确的是 ( )
A.标准状况下,12g C60中含有的碳原子数为NA
B.3.9g金属钾变为钾离子时,失去的电子数为NA
C.标准状况下,11.2 L氯仿中含有的C-Cl键的数目为1.5NA
D.1mol FeCl3完全水解转化为氢氧化铁胶体后能生成NA个胶粒
7.在强碱溶液中,下列各组离子能够大量共存的是 ( )
A.Mg2+、Ca2+、HCO3-、Cl- B.Na+、Al3+、ClO-、SO42-
C.K+、Fe2+、SO42-、Br- D.ClO-、K+、Cl-、SO42-
6.下列各组表达式表示意义相同的是 ( )
A.-NO2、NO2 B.-OH、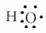
C.CH3CH2OH、CH3OCH3 D.HCOOCH3、HOOCCH3
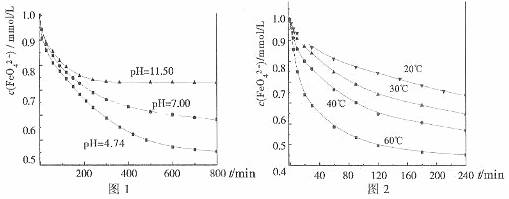
1.0m mol·L-1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,考查不同温度对K2FeO4某种性质的影响,结果见图2。
①实验1的目的是 ;
②实验2可得出的结论是 ;
③高铁酸钾在水中的反应为:FeO42-+10H2O 4Fe(OH)3+8OH-+3O2↑
4Fe(OH)3+8OH-+3O2↑
由图1可知,800min时,初始pH=11.50的溶液中,高铁酸钾的最终浓度比pH=4.74的溶液中高,主要原因是 。
28.(12分)高铁酸钾(K2FeO4)具有极强的氧化性,因该物质具有“绿色”、选择性高、活性强等特点受到人们关注。
(1)高锰酸钾制备方法之一为:
①在一定温度下,将氯气通入KOH溶液中制得含有次氯酸钾的溶液;
②在剧烈搅拌条件下,将Fe(NO3)3分批加入次氯酸钾溶液中,控制反应温度,以免次氯酸钾分解;
③加KOH至饱和,使K2FeO4充分析出,再经纯化得产品,其纯度在95%以上。
①氯碱工业中制备氯气的化学方程式是 ;
②温度过高会导致次氯酸钾自身分解生成两种化合物,产物之一是氯酸钾(KClO3),
另一种产物应该是 (写化学式)。
③制备过程有一步反应如下,请配平方程式(将计量数填入方框中):
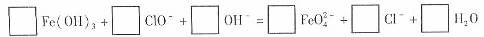
(2)为探究高铁酸钾的某种性质,进行如下两种实验:
实验一:将适量K2FeO4分别溶解于pH为4.74、7.00、11.50的水溶液中,配的
FeO42-浓度为1.0m mol·L-1(1 m mol·L-1=1×103 mol·L-1)的试样,分别静置800min,考查初始pH不同的水溶液对K2FeO4某种性质的影响,结果见图1。
实验二:将适量K2FeO4溶解于pH=4.74的水溶液中,配制成FeO42-浓度为
27.(17分)A-F六种元素中,除A外均为短周期元素,它们的原子结构或性质如表所示:
|
序号 |
元素 |
结构或性质 |
|
① |
A |
生活中常见的金属,它有两种氯化物,相对分子质量相差35.5 |
|
② |
B |
二价阳离子与Ne原子具有相同的电子层结构 |
|
③ |
C |
形成化合物种类最多的元素之一,其单质为固体 |
|
④ |
D |
地壳中含量最多的元素 |
|
⑤ |
E |
与D同主族 |
|
⑥ |
F |
与E同周期,且最外层电子数等于电子层数 |
(1)A的某种氯化物的浓溶液可用于制作Cu印刷电路板,写出相关反应的离子方程式:
。
(2)CD2能与上述某元素形成的物质发生置换反应,该反应化学方程式是 。
(3)F的最高价氧化物对应水化物常用于治疗胃酸(含盐酸)过多症,请写出有关反应的离子方程式 。
(4)B与D形成的化合物的电子式是 。
(5)B与F形成的合金是工业上重要的材料。某同学仅使用天平和下图所示的装置测定某些数据即可求出该合金中B元素的含量。
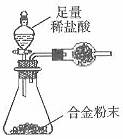
①实验需要测定合金的质量m和另外2个物理量a、b。
a是 ;b是 ;
②干燥管中盛放的试剂最好是 。
③合金中B元素的质量分数是 。(用m、a、b表示。)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com