
1.下列五组物质互为同素异形体的是 ( )
①16O2和18O2 ②H2SiO3和H4SiO4 ③O2和O3 ④H2O和H2O2
⑤金刚石、石墨和C60 ⑥红磷和白磷
A.只有②③⑤ B.只有③⑤⑥ C.只有①③⑤ D.只有①②④⑥
31.酸工业生产中的尾气可用纯碱溶液吸收,有关的化学反应为:
2NO2 + Na2CO3 → NaNO2 + NaNO3 + CO2↑ ①
NO + NO2 + Na2CO3 → 2NaNO2 + CO2↑ ②
(1)根据反应①,每产生22.4L(标准状况下)CO2,吸收液质量将增加 g。
(2)配制1000g质量分数为21.2%的纯碱吸收液,需Na2CO3·10H2O多少克?
(3)现有1000g质量分数为21.2%的纯碱吸收液,吸收硝酸工业尾气,每产生22.4L(标准状况)CO2时,吸收液质量就增加44g。
① 计算吸收液中NaNO2和NaNO3物质的量之比。
② 1000g质量分数为21.2%的纯碱在20℃经充分吸收硝酸工业尾气后,蒸发掉688g水,冷却到0℃,最多可析出NaNO2多少克?(0℃时,NaNO2的溶解度为71.2g/100g水)
30.铜既能与稀硝酸反应,也能与浓硝酸反应,反应方程式为:
Cu+4HNO3(浓)→Cu(NO3)2+2NO2↑+2H2O;
3Cu+8HNO3(稀)→3Cu(NO3)2↑+2NO+4H2O。
现将25.6g Cu投入50mL 12mol/L的浓硝酸中,充分反应后,收集到4.48L(标准状态)NO和NO2的混合气体。
(1)被还原硝酸的物质的量是 ;
(2)判断25.6g Cu和50mL 12mol/L的硝酸反应后何者有剩余? ,其物质的量是 ;
(3)如果4.48L(标准状态)NO和NO2的混合气体是通过排水法进行收集,则收集到的气体的体积是 L气体(标准状态);
(4)如果往反应后的体系内再加入200mL 4mol/L的稀硫酸,又会产生__________ L气体(标准状态)。
29.酚是重要的化式原料,通过下列流程可合成阿司匹林.香料和一些高分子化合物。
已知:

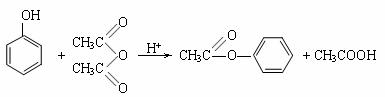
(1)写出C的结构简式 。
(2)写出反应②的化学方程式 。
(3)写出G的结构简式 。
(4)写出反应⑧的化学方程式 。
(5)写出反应类型:④ ⑦ 。
(6)下列可检验阿司匹林样品中混有水杨酸的试剂是 。
(a) 三氯化铁溶液 (b) 碳酸氢钠溶液 (c)石蕊试液
28.从某些植物树叶提取的挥发油中含有下列主要成分:

(1)写出A的分子式 。
(2)1molB与溴水充分反应,需消耗 mol单质溴。
(3)写出C在一定条件下与足量H2反应的化学方程式:
。
(4)已知: RCH=CHR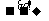 RCOOH+R,COOH。写出C在强氧化剂条件下生成的有机化合物的结构简式
。
RCOOH+R,COOH。写出C在强氧化剂条件下生成的有机化合物的结构简式
。
(5)写出A与B在一定条件下相互反应,生成高分子化合物的化学方程式:
。
27.某化学课外兴趣小组探究铜与浓硫酸的反应情况。甲、乙、丙三位同学进行了下列实验:取12.8g铜片和20ml18mol/L的浓硫酸放在圆底烧瓶中共热,直至反应完毕,最后发现烧瓶中还有铜片剩余外,同时根据所学的知识认为还有较多的硫酸剩余。
(1)请写出铜跟浓硫酸反应的化学方程式:______________________________ ,试问:为什么较多的余酸不再与铜片继续反应?简述理由:_______________。
可以证明有余酸的实验方案是________(填写字母,错选或多选扣分)
(a)再加入铁粉(b)再滴入BaCl2溶液(c)再加入银(d)再滴入Na2CO3溶液
(2)甲学生设计求余酸浓度的实验方案是测定产生气体的量。其方法有多种,请问下列方案中不可行的是________(填写字母,错选或多选扣分)
(a)将产生的气体缓缓通过预先称量盛有碱石灰的干燥管,结束反应后再次称量。
(b)将产生的气体缓缓通入酸性高锰酸钾溶液,再加入足量BaCl2溶液,过滤、洗涤、干燥、称量沉淀。
(c)用排水法测定其产生气体的体积(折算成标准状况)。
(d)用排饱和NaHSO3溶液的方法测出其产生气体的体积(折算成标准状况)。
(3)乙同学设计测定余酸浓度的实验方案是:测定反应后的混合液中Cu2+的量。在反应后的溶液中加蒸馏水稀释至100ml,加入足量Na2S溶液,充分反应后,过滤、洗涤、干燥、称量沉淀。请写出生成沉淀的离子方程式:
___________________________________。
(4)根据甲、乙两同学的实验方案,除测算产生气体的物质的量或反应掉的铜的物质的量外,尚缺少的测量数据是_________________________________。
(5)丙同学提出甲、乙两同学的实验方案设计的复杂,为此他设计了下列较为简易的实验方案:取出反应后的铜片,进行洗涤、干燥、称量。若称得剩余铜片的质量为Wg,测得反应后溶液的体积为Vml,请计算剩余硫酸的物质的量浓度=_____mol/L(用含W、V的代数式表示)
26.我国化学侯德榜(下图)改革国外的碱生产工艺,生产流程可简要表示如下:

(1) 上述生产纯碱的方法称 ,副产品的一种用途为 。
(2) 沉淀池中发生的化学反应方程式是 。
(3) 写出上述流程中X物质的分子式 。
(4) 使原料氯化钠的利用率从70%提高到90%以上,主要是设计了 (填上述流程中的编号)的循环。从沉淀池中取出沉淀的操作是 。
(5)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加 。
(6) 向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有 。
(a) 增大NH4+的浓度,使NH4Cl更多地析出 (b) 使NaHCO3更多地析出
(c) 使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
25.在体积为l L的密闭容器中,充入lmol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g)  CH3OH(g)+H2O(g) + 49.0 kJ
CH3OH(g)+H2O(g) + 49.0 kJ
测得CO2和CH3OH(g)的浓度随时间变化如图所示:
|
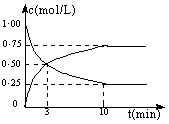
(1)从反应开始到第10 min,氢气的平均反应速率v(H2)= ,在这段时间内,反应放出的热量= 。
(2)在该条件下,反应的平衡常数K的值 = (保留2位小数),如果在某一时刻保持温度不变,只改变浓度,使c(CO2) =1.00 mol/L,c(H2) = 0.40 mol/L,c(CH3OH) = c(H2O) = 0.80 mol/L,则平衡 (填写序号)。
a.向正反应方向移动 b.向逆反应方向移动
c.不移动 d.无法确定平衡移动方向
(3)下列措施中能使n(CH3OH)/n(CO2)增大的是 (填写序号)。
a.升高温度 b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离 d.再充入l mol CH3OH(g)
(4)在催化剂的作用下,CO2与H2能够合成许多物质,如甲醇、烃类、二甲醚等,但反应体系中混入杂质,则反应很难进行,可能的原因是 。
24.一个完整的氧化还原反应方程式可以拆成两个“半反应式”:一个是“氧化反应式”,一个是“还原反应式”。如:2Fe3+ +Cu→2Fe2+ + Cu2+的拆写结果是:
氧化反应式是:Cu-2e-→Cu2+;还原反应式是:2Fe3+ + 2e-→2Fe2+
(1)完成并配平下列化学方程式:
___K2Cr2O7 +___KI+___H2SO4→___Cr2(SO4)3 +___I2 +___K2SO4+___H2O
①上述反应中还原剂是__________,每生成1mol Cr3+ 转移电子____________个。
②请将上述反应拆写成两个半反应式:(用离子表示)
氧化反应式是:________________________________;
还原反应式是:________________________________
(2)已知某个反应的半反应式:CH4 + 10OH- -8e- → CO32- + 7H2O
O2 + 2H2O + 4e- → 4OH-
则总反应的离子方程式为_________________________________________________。
23.Q、R、X、Y、Z是原子序数依次增大的五种短周期元素,在短周期的所有元素中Q的原子半径与Z的原子半径之比最小(不包括稀有气体),R、X、Y三种元素的原子核外电子层数相同,同一周期中R的一种单质的熔点最高,Y与Q、R、X、Z均能形成多种常见化合物。
(1)X在周期表中的位置: ,其原子核外有 种不同形状的电子云。这五种元素中,最外层有两个未成对电子的元素是 (用元素符号表示)。
(2)ZYQ的电子式是_______________ 。
(3)Q分别与X、Y形成的最简单化合物的稳定性_________>_______(用分子式表示)
(4)Q与R两元素组成的分子构型可能是 (填写序号)。
a.直线型 b.平面形 c.三角锥形 d.正四面体
(5)常温下液态化合物甲只含上述元素中的两种,分子中原子个数比1︰1,请你仅用一个化学方程式表示甲既有氧化性又有还原性___________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com