
9.下列说法正确的是 ( )
A.离子晶体中每个离子周围均吸引6个带相反电荷的离子
B.原子晶体中各相邻的原子都以共价键相结合
C.分子晶体的熔沸点较低,常温下都以液体和气体形式存在
D.金属晶体由金属离子和阴离子构成
8.设NA表示阿伏加德罗常数的数值,下列说法正确的是 ( )
A.加热含0.2mol H2SO4的浓硫酸与足量铜反应,生成的SO2的分子数为0.1NA
B.1molCnH2n+2含有(3n+1)NA个共价键
C.2.24L氮气和氧气的混合气体中所含原子数为0.2NA
D.1L 0.5 的CuCl2溶液中含有0.5NA个Cu2+
的CuCl2溶液中含有0.5NA个Cu2+
7.近日来,沈城“巨能钙”事件沸沸扬扬,原因在于部分巨能钙被检出含有双氧水,而双氧水有致癌性,可加速人体衰老。因此卫生部已开始加紧调查“巨能钙”事件。下列有关说法错误的是 ( )
A.双氧水是绿色氧化剂,可作医疗消毒剂,说明H2O2对人体无害
B.H2O2、 Na2O2中都存在非极性共价键
C.H2O2既有氧化性,又有还原性,与KMnO4反应时表现H2O2的还原性
D.H2O2做漂白剂是利用其氧化性,漂白原理与HClO类似,和SO2不同
6.化学与生产、生活、社会密切相关。下列有关说法中不正确的是 ( )
A.2008年诺贝尔化学奖被授予研究“绿色荧光蛋白质”的美籍华裔科学家钱永健等人。蛋白质都是由氨基酸形成的不可降解的高分子化合物,其水溶液有丁达尔效应
B.神七宇航员所穿航天服是由我国自行研制的新型“连续纤维增韧”航空材料做成主要成分是由碳化硅、陶瓷和碳纤维复合而成的,它是一种新型无机非金属材料
C.同一物质溶于不同的物质时可形成不同的分散系,如将NaCl溶于水可形成溶液,溶于酒精则可形成胶体
D.2008年北京奥运会开幕式上的“脚印”等焰火让全世界为之欢呼、倾倒,这主要是利用了化学中“焰色反应”的有关知识
29.(11分)海南省是海洋大省,海水是一种丰富的资源,工业上从海水中可提取许多种物质,广泛应用于生活、生产、科技等方面。下图是某工厂对海水资源进行综合利用的示意图。
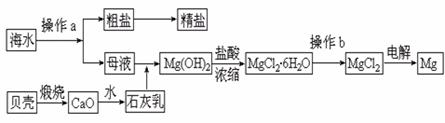
回答下列问题:
(1)流程图中操作a的名称为 。
(2)工业上从海水中提取的NaCl,可用来制取纯碱,其简要过程如下:向饱和食盐水中先通入气体A,后通入气体B,充分反应后过滤得到晶体C和滤液D,将晶体C灼烧即可制得纯碱。
①则气体A应是 (填化学式)其过程反应方程式为_______________________。
②滤液D中主要含有NH4Cl、NaHCO3等物质,工业上是向滤液D中通入NH3,并加入细小食盐颗粒,冷却析出不含有NaHCO3的副产品NH4Cl晶体,则通入NH3的作用是 。
(3)镁是一种用途很广的金属材料,目前世界上60%的镁从海水中提取。操作b是在 气氛中进行,若在空气中加热,则会水解生成Mg(OH)Cl,写出有关反应的化学方程式_____________________________________________。
(4)一氯碱厂每天消耗234吨NaCl,这些NaCl能生产质量分数为32%的烧碱溶液________吨,同时消耗______________库电量(1电子电量1.60×10-19C)
28.据环保部门测定,我国一些大城市的酸雨pH=3.5。在酸雨季节铁制品极易腐蚀,则在其腐蚀中正极发生的反应是 ( )
A.Fe-2e-=Fe2+ B.2H2O+O2+4e-=4OH-
C.2H++2e-=H2↑ D.4OH--4e-=2H2O+O2↑
27.在硫酸的工业制法中,下列生产操作及说明生产操作的主要原因二者都正确的是( )
A.从沸腾炉出来的炉气需净化,因为炉气中SO2会与杂质反应
B.硫铁矿燃烧前需要粉碎,因为大块的不能燃烧
C.SO3用98.3%的浓硫酸吸收,目的是防止形成酸雾,有利于SO3吸收完全
D.SO2氧化为SO3时需要使用催化剂,这样可以提高SO2的转化率
26.下列关于工业生产的说法中,不正确的是 ( )
A.无水氯化镁的制备:MgCl2·6H2O MgCl2+6H2O
MgCl2+6H2O
B.生产普通玻璃的主要原料有石灰石、石英和纯碱
C.工业上将粗铜进行精炼,应将粗铜连接在电源的正极
D.漂粉精的制备:2Ca(OH)2+2Cl2=Ca(ClO)2+CaCl2+2H2O
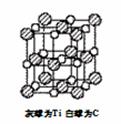
25.钛已作为常用金属铁、铝后的第三金属,我国钛矿储量丰富,它的应用研究是目前科学研究的前沿之一。 2007年诺贝尔物理学奖为法国科学家阿尔贝。费尔和德国科学家彼得·格林贝格尔共同获得,以表彰他们在巨磁电阻效应(MR效应)研究方面的成就,某钙钛型复合氧化物(如下图),以A原子为晶胞顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Ti、Fe时,这种化合物具有CMR效应。

(1)写出该晶体的化学式________________
(2)Ti的核外电子排布式为_______它位于周期表中______区,价电子排布为________。
(3)锰的电负性为1.99。Cr的电负性为1.66,说明锰的金属性比铬_____(强、弱)
(4)最近发现钛(Ti)原子和碳原子构成气态团簇分子,分子模型如图。则其化学式为______。它属于______晶体,其主要物理性质____________ __________(写出2个即可)
《化学与技术》
26-28为选择题,每小题只有一个正确选项,每小题3分
24.某有机物(名称乙烯酮)的结构简式为:CH2=C=O,下列描述正确的是( )
A.该分子中共有2个π健、2个σ健
B.该分子属非极性分子
C.该分子是直线型分子
D.该分子中2个碳原子的杂化方式是不同的
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com