
5.某FeSO4、Fe2(SO4)3、H2SO4的混合溶液100mL,已知溶液中阳离子的浓度相同(不考虑水解),且SO42-的物质的量浓度为6mol/L,则此溶液最多可溶解铁粉的质量为( )
A.11.2g B.16.8g C.19.6g D.22.4g
4.在相同条件下,A气体的密度是B气体密度的8倍,由等物质的量的A、B两种气体组成的混合气体的密度是相同条件下B气体密度的 ( )
A.3倍 B.4.5倍 C.6倍 D.9倍
3.已知3.6碳在6.4g的氧气中燃烧,至反应物耗尽,并放出X kJ热量。已知单质碳的燃烧热 Y kJ/mol,则1molC与O2反应生成CO的反应热△H为 ( )
A.-Y kJ/mol B.-(10X – Y) kJ/mol
C.-(5X – 0.5Y) kJ/mol D.+(10X – Y) kJ/mol
2.一定量的Na2O2与CO2反应后的固体物质14.8g,恰好与1L1mol·L-1的稀盐酸溶液完全反应,下列说法正确的是 ( )
A.41.8g固体物质为Na2CO3
B.41.8g固体物质为0.1mol Na2CO3和0.4mol Na2O2
C.41.8g固体物质为31.2gNaHCO3和10.6gNa2CO3混合物
D.一定量的Na2O2为78g
1.取一定量的某有机物在空气中完全燃烧,测得生成CO2和H2O的物质的量之比为2:3,则该有机物的分子式不可能是 ( )
A.CH4 B.C2H6 C.C2H6O D.C2H6O2
25.工业合成氨的反应为N2+3H2 2NH3。设在容积为2.0L的密闭容器中充入0.6molN2和1.6molH2,反应在一定条件下达到平衡时,NH3的物质的量分数为4/7。计算:
2NH3。设在容积为2.0L的密闭容器中充入0.6molN2和1.6molH2,反应在一定条件下达到平衡时,NH3的物质的量分数为4/7。计算:
(1)该条件下N2的平衡转化率;(保留到0.1%)
(2)该条件下反应N2+3H2  2NH3的平衡常数。
2NH3的平衡常数。
24.(9分)在2L的密闭容器中,加入2molA和1molB,发生下述反应:
2A(g)+B(g) 2C(g)+D(s)达到平衡时,C的浓度为0.4mol·L-1
2C(g)+D(s)达到平衡时,C的浓度为0.4mol·L-1
(1)温度不变,若缩小容器的体积,则平衡 移动(填正向、逆向或不)
(2)维持容器的温度和体积不变,按下列四种配比作为起始物质,达到平衡后,C的浓度仍是0.4mol·L-1的是 。
A.4molA+2molB B.2molC+1molD
C.2molA+1molB+2molC+1molD D.1molA+0.5molB+1molC+0.2molD
(3)若维持容器的体积和温度不变,按不同配比加入起始物质,达到平衡时,C的浓度仍是0.4mol·L-1。
①反应从逆反应方向开始,则D的起始物质的量应满足的条件是
②若加入0.2molA和0.1molB,则C和D起始物质的量分别应满足 ,
23.(11分)不同元素的原子在分子内吸引电子的能力大小可用一定数值x来表示,若x越大,其原子吸引电子的能力越强,在所形成的分子中成为负电荷一方。
下面是某些短周期元素的x值;
|
元素符号 |
Li |
Be |
B |
C |
O |
F |
Na |
Al |
Si |
P |
S |
Cl |
|
x值 |
0.98 |
1.57 |
2.04 |
2.55 |
3.44 |
3.98 |
0.93 |
1.61 |
1.90 |
2.19 |
2.58 |
3.16 |
(1)通过分析x值变化规律,确定N、Mg的x值范围;
<x(Mg)< , <x(N)< 。
(2)推测x值与原子半径的关系是 ;根据短周期元素x值变化特点,体现了元素性质的 变化规律。
(3)某有机化合物结构式为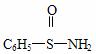 ,其中S-N中,你认为共用电子对偏向谁?
,其中S-N中,你认为共用电子对偏向谁?
(写原子名称)。
(4)经验规律告诉我们:设成键的两原子相应元素的差值(△x),当△x>1.7时,一般为离子键,当△x<1.7时,一般共价键,试推断AlBr3中化学键类型是 。
(5)预测元素周期表中,x值最小的元素位置: (放射性元素除外)。
22.(10分)下图是一个实验室制取氯气并以氯气为原料进行特定反应的装置:
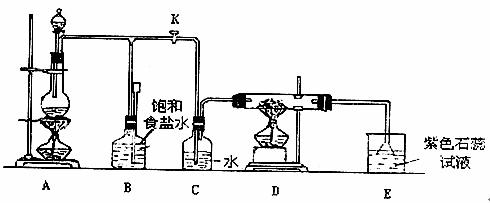
(1)A是氯气发生装置,其中反应的化学方程式 。
(2)实验开始时,先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃D处酒精灯,连接上E装置。Cl2通过C瓶后再进入D。D装置的硬质玻璃管内盛有炭粉,发生氧化还原反应,其产物为CO2和HCl。试写出D中反应的化学方程式:
。装置C的作用是 。
(3)在E处,紫色石蕊试液的颜色由紫变为红色,再变为无色,其原因是 。
(4)若将E处烧杯中溶液改为澄清石灰水,反应过程中的现象为 。(选填标号)
A.有白色沉淀生成 B.无现象
C.先生成白色沉淀,而后白色沉淀消失
(5)D处反应完毕后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有Cl2产生,此时B中的现象是 ,B的作用是 。
21.(10分)下图中每一方框表示有关的一种反应物或生成物,其中B、D为无色气体。
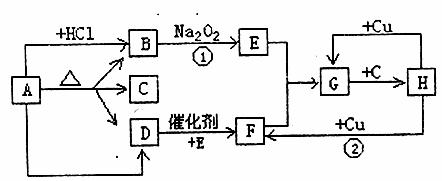
(1)上图中A名称为 或 ,B的电子式 ,D的空间构型为 ,G的颜色 。
(2)反应①的化学方程式为 。
(3)反应D~F中每生成1g液态C需吸收akJ的热量,则D~F的热化学方程式为:
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com