
26.(16分)已知将浓盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去。现有一氧化还原反应的体系、共有KCI、C12、浓H2SO4、H2O、KMnO4、MnSO4、K2SO4七种物质:
(1)该氧化还原反应的体系中,还原剂是 ,化合价没有发生变化的反应物是 。
(2)写出上述反应的化学方程式(需配平) 。
(3)如果在反应后的溶液中加入NaBiO3,溶液又变为紫红色,BiO3-反应后变为无色的Bi3+。该实验证明NaBiO4具有 性,上述反应的离子反应方程式: ,该反应中每生成l mol Bi3+转移的电子数为 。
13.如图所示,a、b是两根石墨棒,下列叙述不正确的是 ( )

A.往滤纸上滴加酚酞试液,b极附近颜色变红
B.a是正极,发生还原反应,b是阴极,发生氧化反应
C.稀硫酸中硫酸根离子的物质的量不变
D.装置工作时,稀硫酸溶液中c(H+)变小、C(Zn2+)变大
第Ⅱ卷(非选择题。共174分)
12.把0.lmol铝投入到100mL3mol/L的NaOH溶液中充分反应后,再滴入1mol/L的H2SO4120mL,其结果 ( )
A.溶液的pH<7 B.得到澄清透明溶液
C.有沉淀生成 D.先有白色沉淀生成,后逐渐溶解
11.25℃时,重水(D2O)的离子积为1.6×10-15,也可用PH值一样的定义来规定其酸碱度:PD=-lgC(D+),下列叙述正确的是 ( )
①中性D2O的PD=7
②在1LD2O的溶液中溶解0.01molDCl,其PD值为1
③溶解有0.2mol NaOD的重水溶液,PD=12
④在100mL0.25mol/LDC1的重水溶液中,加入50mL 0.2mol/L NaOD的重水溶液,反应后溶液的PD=1
⑤温度升高,C(D+)×C(OD-)的值会升高
A.②③ B.③④ C.①② D.④⑤
9.下列各组混合物的分离或提纯方法不正确的是 ( )
A.除去溴化钠溶液中含有碘化钠:加入氯水充分振荡后,再加四氯化碳,萃取分液
B.用结晶法提纯NaC1和KNO3的混合物中KNO3
C.用蒸馏法分离汽油和柴油混合物
D.除去FeC12溶液中的少量FeC13:加入足量铁屑,充分反应后,过滤
|

8.下列各组化合物的性质比较,不正确的是 ( )
A.酸性:HC1O4 > HBrO4 > HIO4
B.碱性:Ba(OH)2 > Ca(OH)2 > Mg(OH)2
C.稳定性:HC1>H2S>PH3
D.沸点:HF>HC1>HBr>HI
7.下列离子方程式书写正确的是 ( )
A.碳酸氢钙溶液加到醋酸中:Ca(HCO3)2+2CH3COOH=Ca2++2CH3COO-+2CO2↑+2H2O
B.FeI2溶液中通入少量的C12:2Fe2++C12=2Fe3++2C1-
C.饱和FeC13溶液滴入沸水中:Fe3++3H2O=Fe(OH)3(胶体)+3H+
D.NaHCO3溶液中通入过量的Ba(OH)2溶液:2HCO3-+Ba2++2OH-=BaCO3↓+2H2O+CO32-
6.下列各项表述正确的是 ( )
A.双氧水的电子式 B.醛基官能团符号:-COH
B.醛基官能团符号:-COH
C.铝离子结构示意图: D.异丁烷的结构简式:CH3CH(CH3)CH3
D.异丁烷的结构简式:CH3CH(CH3)CH3
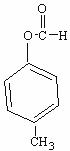
29.(15分)已知:


若从A出发可发生下图所示的一系列反应,其中B的分子式为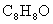 ,且苯环上的一元取代物只有2种;G为高分子化合物。试填写下列空白:
,且苯环上的一元取代物只有2种;G为高分子化合物。试填写下列空白:

(1)写出 的结构简式
的结构简式
(2)指出反应Ⅲ的反应类型 。
(3)写出下列反应的化学方程式:

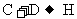 。
。
(4)与C互为同分异构体且均属于酯类的芳香族化合物共有6种,除下列4种外,另外两种同分异构体的结构简式为 、 。
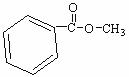

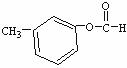
28.(15分)氢氧化铜是一种常用试剂。例如,利用新制氢氧化铜验证葡萄糖的还原性。
I.实验室制取新制氢氧化铜悬浊液的操作方法:在试管里加入10%的氢氧化钠溶液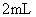 ,滴入2%的硫酸铜溶液4滴-6滴,振荡即成。这样操作的目的是
。
,滴入2%的硫酸铜溶液4滴-6滴,振荡即成。这样操作的目的是
。
下面是三个研究性学习组分别从不同层面开展研究性学习活动:
Ⅱ.研究性学习小组甲:对教材实验结论“乙醛与新制氢氧化铜反应生成的红色沉淀是 ”提出质疑,他们认为红色沉淀不一定是氧化亚铜。为了确定红色沉淀的成分,开展了如下研究:提出猜想:
。
”提出质疑,他们认为红色沉淀不一定是氧化亚铜。为了确定红色沉淀的成分,开展了如下研究:提出猜想:
。
查阅资料:①氧化亚铜属于碱性氧化物;②+1价的铜离子在酸性条件易发生自身氧化还原反应;③在空气中灼烧氧化亚铜能生成氧化铜。
设计方案:
方案1:取该红色沉淀溶于足量的稀硝酸中,观察溶液颜色变化
方案2:取该红色沉淀溶于足量的稀硫酸中,观察是否有残渣
方案3:称取红色沉淀 ,在空气中充分灼烧至完全变黑,并在干燥器里冷却,再称重,反复多次直到固体恒重,称得质量为
,在空气中充分灼烧至完全变黑,并在干燥器里冷却,再称重,反复多次直到固体恒重,称得质量为 ,比较
,比较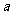 、
、 的大小关系
的大小关系
方案4:取红色固体沉淀装入试管里,加入酸化的硝酸银溶液,观察是否有银白色银析出你认为合理的方案是 。
Ⅲ.研究性学习小组乙针对小组甲的质疑,设计新的探究方案,装置如下图所示。你认为要测定上述红色沉淀成分必须测定下列哪些物理量: 。
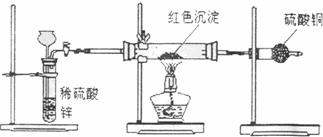
①通入氢气的体积; ②反应前,红色沉淀+硬质试管的总质量;
③完全反应后,红色固体+硬质试管的总质量;
④实验前,干燥管的质量;⑤硬质试管的质量;⑥锌粒的质量;⑦稀硫酸中含溶质的量;⑧实验后,干燥管的质量
Ⅳ.研究性学习小组丙上网查阅新闻得知“2005年诺贝尔化学奖授予了三位研究绿色化学的科学家”。绿色化学强调对环境友好,实现零排放。“变废为宝”符合绿色化学要求。他们收集上述红色沉淀用于制备化学试剂--蓝矾。请你将他们设计的一个简单且符合绿色化学要求的实验方案补充完整:
在空气中充分灼烧该红色固体至全部转化成黑色氧化铜,再加入足量(填物质名称)充分反应,加热蒸发浓缩、 、过滤、 ,用滤纸吸干或通入惰性气体带走水分即可。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com