
8.下图所示实验装置的说法正确的是 ( )

A.装置①可用于实验室制乙烯
B.制Cl2时,可用装置②进行干燥
C.通过控制装置③中的a、b可用于收集并吸收多于的NH3
D.在检查装置①的气密性时,分液漏斗的下端必须插到液面下
7.下列叙述正确的是 ( )
A.淀粉、纤维素、油脂都属于高分子化合物
B.乙烯、聚乙烯、苯乙烯分子中都含有碳碳双键
C.对混有少量苯酚的苯,可通过加浓溴水充分反应后过滤除去
D.等物质的量的蚁醛和乙醛分别与足量银氨溶液充分反应,所产生银的质量不相等
6.下列说法正确的是 ( )
A. 的原子序数是27
的原子序数是27
B.金刚石和C60互为同素异形体
C.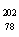 Pt和
Pt和 Pt的中子数相同,互称为同位素
Pt的中子数相同,互称为同位素
D.18.0 g重水(D2O)中所含的质子数为10NA
29.(16分)为测定碳酸钙纯度(设含杂质SiO2),某学生设计了如下几个实验方案,请回答每个方案中的问题。
[方案甲](1)称取碳酸钙样品m g;(2)加入过量盐酸;(3)收集并测定生成的气体体积V mL。
问题:如果称量样品时,砝码底部有一处未被实验者发现的残缺,那么测定的碳酸钙的纯度会 (填偏高、偏低或无影响)。
[方案乙](1)称取碳酸钙样品m g;(2)用c mol/L盐酸V mL(过量)溶解样品;(3)取溶解后的溶液 mL,用c′mol/L NaOH溶液滴定,恰好用去V′mL。
问题1:列出本实验中必须用到的仪器名称(除铁架台及附件、烧杯、托盘天平(砝码)、药匙之外) 。
问题2:加盐酸后是否需要滤出SiO2后再用NaOH滴定? 。
A.需要 B.不需要 C.均可
问题3:碳酸钙纯度计算公式:
[方案丙](1)称取碳酸钙样品m g;(2)高温(1000℃)煅烧直至质量不再发生变化,冷却后称量,质量为m′g。
问题:本方案中的“冷却”应如何操作?
综上所述,你认为3个方案中,最好的方案是 ,其他方案的缺点分别是:
方案
方案
28.(15分)乙偶姻是一个极其重要的香料品种,主要用于配制奶香型、肉香型、草莓香型香精,也可用于合成其他精细化学品。已知乙偶姻中只含有C、H、O三种元素,其相对分子质量为88,分子中C、H、O原子个数比为2∶4∶1。请回答:
已知:

乙偶姻中含有碳氧双键,A的一氯代物只有一种。与乙偶姻有关的反应如下:

(1)X是乙偶姻的同分异构体,且属于酯类,写出其所有可能的结构简式:
(2)写出反应①、②的反应类型:反应① ,反应② 。
(3)写出A、乙偶姻、C的结构简式:
A 、乙偶姻 、C 。
(4)写出D→E反应的化学方程式:
27.(13分)甲、乙、丙、丁、戊均为中学化学常见的单质或化合物,且均含有同一种元素R,在一定条件下其转化关系如下图所示。

(1)若R为一种非金属元素,甲与丙为常见大气污染物,且甲与丙的相对分子质量相差16,丁为空气的主要成分之一。则丁的结构式为 ,戊的稀溶液能跟过量铁粉反应,其离子方程式为 ,乙的空间构型为 。
(2)若R为一种金属元素,甲溶液的pH小于7,乙由两种元素组成,单质丁在一定条件下可生成戊。甲与戊两种溶液混合能生成沉淀丙,其离子方程式为 ,若镁粉中混有少量的丁,除去丁的离子方程式为 。
26.(16分)W、X、Y、Z四种短周期元素,原子序数依次增大,在周期表中W与X相邻、Y与Z相邻。已知W元素的氢化物与Z元素的氢化物反应只生成一种盐a;X、Y位于同一主族,它们能组成YX2、YX3两种常见化合物。请回答下列问题:
(1)X元素位于周期表中第 族。
(2)X、Y、Z三种元素形成的单质中,氧化性最弱的是 (填化学式)。
(3)Y与Z可形成共价化合物Y2Z2,分子中Y与Z均满足8电子稳定结构,则Y2Z2的电子式为 。
(4)a溶液的pH (填“>”、“<”或“=”)7,用离子方程式解释: 。
(5)取pH=0的W的最高价氧化物对应水化物溶液100.0 mL于某容器中,加入0.90 g Cu、Ag合金样品,充分反应后测得生成WO(其中O表示氧元素)气体的体积为156.8 mL(标准状况下),反应后容器中溶液的c(H+)=0.72 mol·L-1(假设反应后溶液体积不变)。
若设Cu、Ag的物质的量分别为x、y。欲求x、y的值,可列出下列计算式:
①64x+108y=0.90,该计算式是依据 关系列出的。
②2x+y=3×0.1568 L÷22.4 L·mol-1,该计算式依据的是 。
③2x+y=1 mol·L-1×0.1 L-(0.72 mol·L-1×0.1 L+0.1568 L÷22.4 L·mol-1),该计算式依据的是 。
13.下列事实不能用勒沙特列原理解释的是( )
①氯化铁溶液加热蒸干最终得不到氯化铁固体
②铁在潮湿的空气中容易生锈
③实验室可用排饱和食盐水的方法收集氯气
④常温下,将1 mL pH=3的醋酸溶液加水稀释至100 mL,测得其pH<5
⑤钠与氯化钾共融制备钾:Na(l)+KCl(l)===K(g)+NaCl(l)
⑥二氧化氮与四氧化氮的平衡体系,加压后颜色加深
A.①②③ B.只有②⑥ C.③④⑤ D.②⑤⑥
第Ⅱ卷(非选择题)
12.某白色固体可能是由①NH4Cl ②AlCl3 ③NaCl ④AgNO3 ⑤KOH中的一种或几种组成。将此固体投入水中,得澄清溶液,该溶液可使酚酞呈红色,向该溶液中加入稀硝酸至过量,有白色沉淀产生。以下对原固体的判断中不正确的是( )
A.肯定存在① B.至少存在①④⑤
C.无法确定是否有③ D.至少存在②⑤
11.下列叙述不正确的是( )
A.Fe(OH)3胶体进行电泳实验,阴极附近颜色加深
B.在熔融状态下能导电的物质,一定含有离子键
C.用渗析的方法可以除去蛋白质溶液中混有的少量NaCl
D.铜片作阳极,铁片作阴极,电解氯化铜溶液,铁片表面析出铜
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com