
28.(17分)
某学习小组利用下列装置探究氯气和氨气之间的反应,其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气和氨气的反应装置。
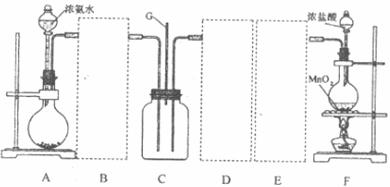
|
|
Ⅰ |
Ⅱ |
Ⅲ |
|
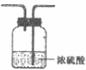
备选装置 |
 |
 |
 |
请回答下列同题:
(1)装置A中烧瓶内的固体可选用
a.烧碱 b.生石灰 c.二氧化硅 d.五氧化二磷
(2)往装置A的烧瓶内加入粉末状固体的操作方法是_________________________。
(3)虚线框内应添加必要的除杂装置,请从上图的备选装置中选择并将编号填入下列空格。
B_________;D__________:E__________(填编号)-
(4)在实验过程中应如何合理控制装置A、F中分液漏斗上口的玻璃塞?
_____________________________________________________________________________
(5)装置C内出现白烟并在容器内壁凝结,鉴定该固体是氯化铵所需要的试剂和试纸除蒸馏水外还有______________________________________________________。
(6)如果C中气体未出现红棕色,写出C中发生反应的化学方程式_______________。
27.(13分)
在一定条件下进行下列化学反应,请根据以下的转换关系回答下列问题,已知A、B、C中均含有同一种元素。
(1)已知:
D为非金属单质。
①若A为非金属单质,则C可能为_____________(需答出三种,写化学式)。
②若A为某无机气态化合物,则C可能为_____________(只需答出一种,写化学式)。
③若A为日常生活中常见的烃的衍生物则C为___________(写分子式)。
(2)已知
①若D为金属单质,且以上反应均为氧化还原反应,请写出检验B中阳离子的一种最佳方法____________________________________________________。
②若:D为碱,焰色反应为黄色且以上反应均为非氧化还原反应,则A、B、C、D分别可以是:(按顺序写出合理的一组物质的化学式即可)A_______________,B_____________,
C_______________,D_______________。
26.本题包括两小题(共15分)
I.(7分)
X、W、Y、Z、V代表原子序数依次减小的五种短周期主族元素,它们满足以下条件:X原子L层电子数是其最外层电子数的2倍;W原子K、L层电子数之和比L、M层电子数之和多1个电子;Z是自然界含量最多的元素;V元素形成的化合物种类是所有元素中最多的。请回答下列问题:
(1)V元素在周期表中的位置为___________。X的最高价氧化物形成的晶体属于_________(填“分子”“原子”“离子”或“金属”)晶体。
(2)Y、Z两元素形成的氢化物中沸点较高的氢化物的电子式是_____________________
(3)W与Z形成的含非极性键的化合物与水反应的离子方程式为________________。
(4)W、Z和V可组成一种化合物,其原子个数出为2﹕3﹕1,该物质的水溶液中各离子浓度由大到小的顺序是____________________________。
Ⅱ.(8分)
现有A、B、C、D、E五种强电解质,它们在水中可电离产生下列离子(各种离子不重复)。
|
阳离子 |
 |
|
阴离子 |
 |
已知:①A、B两溶液呈碱性;C、D、E溶液呈酸性。
②A溶液与C溶液反应只有气体产生。
③D溶液与另外四种溶液反应都能产生沉淀(沉淀包括微溶物)。
④在E溶液中逐滴加入B溶液,溶液先出现沉淀,当滴加至过量时,沉淀部分溶解。
试回答下列问题;
(1)D的名称为_______________。
(2)A溶液呈碱性的原因______________________________________(用离子方程式表示),
(3)已知:1L 1mol·L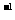 稀硝酸跟1L 1mol·L
稀硝酸跟1L 1mol·L NaOH溶液起中和反应时,放出57.3kJ的热量。请写出B与C的稀溶液反应的中和热的热化学方程式____________________。
NaOH溶液起中和反应时,放出57.3kJ的热量。请写出B与C的稀溶液反应的中和热的热化学方程式____________________。
(4)在100mL0.1mol·L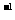 E溶液中,逐滴加入35mL 2mol·L
E溶液中,逐滴加入35mL 2mol·L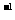 NaOH溶液,最终得到沉淀的物质的量为__________________。
NaOH溶液,最终得到沉淀的物质的量为__________________。
13.下列关于电解质溶液的叙述正确的是
A.0.1mol·L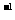 CH3COOH溶液加水稀释,溶液中所有离子浓度均减小
CH3COOH溶液加水稀释,溶液中所有离子浓度均减小
B.某氢氧化钠溶液跟醋酸溶液混合后溶液呈酸性,则混合溶液中离子的物质的量浓度之间的关系是c(H+)=c(CH3COO-)-c(Na+)+c(OH-)
C.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同
D.常温下,相同浓度的CH3COONa溶液与Na2CO3溶液相比,Na2CO3溶液的pH小
第Ⅱ卷
12.已知反应mX(g)+nY(g) qZ(g)的△H<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是
qZ(g)的△H<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是
A.通入稀有气体使压强增大,平衡将正向移动
B.当qv正(X)=mv逆(Z)时,可断定反应达到平衡状态
C.降低温度,混合气体的平均相对分子质量变小
D.若升高温度,则反应中正反应速率减小,逆反应速率增大
11.下列叙述不正确的是
A.同温同压下,5 molO2(g)和2 molH2(g)的体积之比等于5:2
B.等物质的量的甲基(-CH2)与氨基(-NH2)所含电子数相等
C.78 g Na2O2所含阴离子数为6.02X10
D.把100mL3mol·L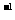 的H2SO2跟100mLH2O混合,硫酸的物质的量浓度变为1.5mol·L
的H2SO2跟100mLH2O混合,硫酸的物质的量浓度变为1.5mol·L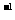
10.观察下列几个装置示意图,有关叙述正确的是

A.装置①中阳极上析出红色固体
B.装置②的镀铁制品应与电源正极相连
C.装置③闭合电键后,外电路电子由a极流向b极
D.装置④的离子交换膜允许阳离子、阴离子、水分子自由通过
9.根据下列实验内容得出的结论正确的是
|
选项 |
实验内容 |
结论 |
|
A |
某物质的水溶液能使红色石蕊试纸变蓝 |
该物质一定是碱 |
|
B |
某气体能使湿润淀粉碘化钾试纸变蓝 |
该气体一定是氯气 |
|
C |
某物质的水溶液加入盐酸产生五色无味气体 |
该溶液一定有碳酸根离子 |
|
D |
0.84g铁和50.00mL1.00mol/L的稀硝酸反应 |
反应后溶液中一定有Fe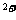 和Fe 和Fe |
8.短周期元素W、X、Y、Z的原子序数依次增大,W与Y、XX与Z位于同一主族,W、X可形成共价化合物WX,Y原子的内层电子总数是其最外层电子数的2.5倍。下列序叙述不正确的是
A.WZ2分子中所有原子最外层都为8电子结构
B.WX2、ZX2的化学键类型和晶体类型都相同
C.WX2是以极性键结合成的非极性分子
D.原子半径大小顺序为X<W<Y<Z
7.据悉,2008年北京奥运会上使用的发令枪所用的“火药”成份是氯酸钾和红磷,经撞击发出响声,同时产生白色烟雾。撞击时发生的化学方程式为:5KClO 3+6P=3P2O5+5KCl,则下列有关叙述错误的是
A,上述反应中的生成物P O
O 是酸性氧化物
是酸性氧化物
B.产生白色烟雾的原因是生成KCl和P O
O 白色固体小颗粒(烟),P
白色固体小颗粒(烟),P O
O 吸水性很强,吸收空气中的水分,生成磷酸小液滴(雾)
吸水性很强,吸收空气中的水分,生成磷酸小液滴(雾)
C.上述反应中消耗3molP时,转移电子的物质的量为15mol
D.因红磷和白磷互为同分异构体,所以上述火药中的红磷可以用白磷代替
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com