
5.科学家最近发现两种粒子:第一种是只由四个中子构成的粒子,这种粒子称为“四中子”,也有人称之为“零号元素”;第二种是由四个氧原子构成的分子。下列有关这两种粒子的说法不正确的是: ( )
A.“四中子”不显电性
B.“四中子”的质量数为4,其质量比氢原子大
C第二种粒子是氧元素的另一种同位素
D.第二种粒子的化学式为O4,与O2互为同素异形体
4.2005年6月5日是第34个世界环境日,联合国环境署确定的活动主题是“营造绿色城市,呵护地球家园”,我国环保总局确定的主题是“人人参与,创建绿色家园”。下列活动或措施不符合这一主题的是: ( )
A.开发太阳能、水能、风能等新能源,减少煤、石油等化石燃料的使用
B.为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术
C.更新采煤、采油技术,提高产量以满足工业生产的快速发展需要
D.落实资源的“3R”发展观,即:减少资源消耗(Reduce)、增加资源的重复使用(Reuse)和资源的循环再生(Recycle)
3.科学家最近研究发现,生活在海洋中的单细胞浮游生物能收集阳光并从大气中摄取二氧化碳等物质使其转变为食物,在此过程中释放出氧气。下列相关说法错误的是:( )
A.该过程与植物的光合作用类似,可称为“海洋中的光合作用”
B.该过程中没有化学变化
C如果能揭示其中的奥秘,就可能够找到解决温室效应的新方法
D.如果能弄清此变化过程,将有助于人类更好地利用太阳能,缓解能源危机
2.化学史可以帮助我们了解化学的发展,学习化学家研究化学的过程和方法,体会化学家 的研究过程的艰辛和获得成功的喜悦……1869年一位化学家经过长期的研究后提出了 元素周期律,并列出了第一张元素周期表,此化学家是: ( )
A.门捷列夫 B.卢瑟福 C.道尔顿 D.阿伏伽德罗
1.下列物质不属于“城市空气质量日报”报道的是 ( )
A.二氧化碳 B.氮氧化物 C.二氧化硫 D.可吸入颗粒物
29.(18分)已知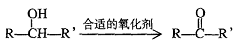 (注:R、R’为烃基)
(注:R、R’为烃基)
A为有机合成中间体,在一定条件下发生消去反应,可能得到两种互为同分异构体的产物,其中的一种B可用于制取合成树脂、染料等多种化工产品。A能发生如下图所示的变化。
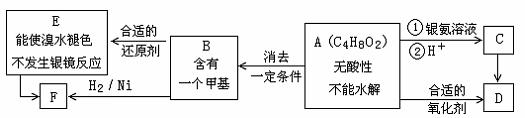
试回答:
(1)写出符合下述条件A的同分异构体结构简式(各任写一种):
a.具有酸性______________________b.能发生水解反应______________________
(2)A分子中的官能团名称是_____________,D的结构简式是_____________。
(3)E→F的反应类型是___________
(4)写出化学方程式:A→B____________________________________________。
(5)写出E生成高聚物的化学方程式:_______________ 。
(6)C的同分异构体Cl与C有相同官能团,两分子Cl脱去两分子水形成含有六元环的X,核磁共振氢谱显示X只有一种波峰,X的结构简式为_____________________。
28.(16分)工业以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱。有关反应的化学方程式为:NH3+CO2+H2O =NH4HCO3;
NH4HCO3+NaCl=NaHCO3↓+NH4Cl
;2NaHCO3 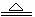 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是 (填字母标号)。
a.碳酸氢钠难溶于水
b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
d.碳酸氢钠的稳定性大于碳酸钠
(2)某活动小组根据上述制碱原理,进行碳酸氢钠的制备实验。
① 一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。
试回答下列有关问题:
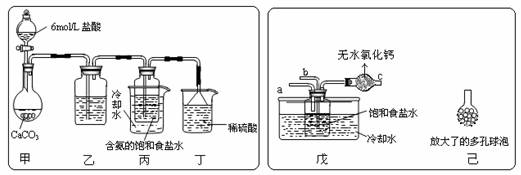
(Ⅰ)乙装置中的试剂是 ,其作用是 ;
(Ⅱ)丁装置中稀硫酸的作用是 ;
(Ⅲ)实验结束后,分离出NaHCO3 晶体的操作是 (填分离操作的名称),该操作所需要的玻璃仪器有
② 另一位同学用图中戊装置(其它装置未画出)进行实验。
(Ⅰ)实验时,须先从a管通入_______气体,说明原因_____________
(Ⅱ)有同学建议在戊装置的b管下端连接己装置,理由是
(3)碳酸氢钠受热所得固体12.28g与足量的石灰水充分反应,所得沉淀经洗涤、干燥质量为12.00g,则所得固体中碳酸钠的质量分数为_____________________。
(4)请你再设计出一种实验室制取少量碳酸氢钠的方法:
27.(16分)中学化学中常见的几种物质存在如下关系,其中甲是黑色非金属单质,乙是生活中常见的金属单质,D是红棕色气体。(图中部分产物和反应条件已略去)
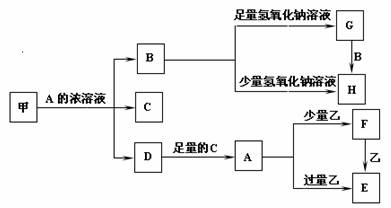
回答下列问题:
(1)写出甲与A的浓溶液反应的化学方程式_________________________________。
(2)C的电子式是___________________________。
(3)除去G固体中含有H杂质采用的方法是________________________。
(4)A溶液与一种能使湿润的红色石蕊试纸变蓝的气体反应,生成一种盐,该盐的溶液呈酸性,其原因是(用离子方程式表示)_____________________________。
(5)写出由F转化为E的离子方程式__________________________________________;
将溶液F加热蒸干、灼烧到质量不再减少时所得固体物质的化学式为_________。
(6)4g单质甲完全燃烧能放出131.17kJ的热量,写出表示单质甲燃烧热的热化学方程式________________________________________。
26.(10)水煤气是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:
C (s) + H2O(g)  CO (g) +H2
(g)
△H= +131.3 kJ•mol-1
CO (g) +H2
(g)
△H= +131.3 kJ•mol-1
(1)在一恒温恒压的容器中投入1.5molC(s)和1molH2O(g),达平衡时吸收的热量为Q1,温度升高20℃达平衡时吸收的热量为Q2,则Q1_____ Q2_____131.3 kJ(>、=、<)
(2)上述反应达到平衡后,增加H2O(g)的量,则C (s) 的物质的量_______________(增大 、 减小 、 不变)。
(3)下列说法一定能判断如上反应达平衡的是
A.消耗1mol H2O(g)同时生成1mol H2
B.容器内混合气体的总质量不变
C.恒温恒容时容器内气体的压强不变
D.H2O(g) 、CO (g) 、H2 (g)三种气体的浓度比为1︰1︰1
(4)上述反应在t0时刻达到平衡,在t1时刻改变某一条件后正反应速率(ν正)随时间的变化如下图所示,填出对应的编号。
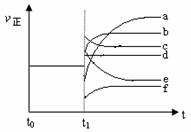
①缩小容器体积_________;
②降低温度____________。
13.关于下列图示的说法中正确的是 ( )
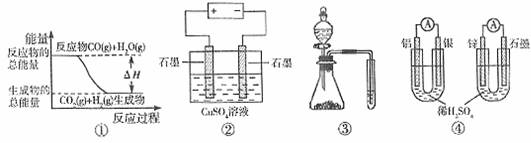
A.图①表示可逆反应:“CO(g)+H2O(g CO2(g)+H2(g)”中的△H大于0
CO2(g)+H2(g)”中的△H大于0
B.图②为电解硫酸铜溶液的装置,一定时间内,两电极产生单质的物质的量之比一定为1:1
C.图③实验装置可完成比较乙酸、碳酸、苯酚酸性强弱的实验
D.图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量也相同
第Ⅱ卷(非选择题)
第Ⅱ卷用0.5mm的黑色签字笔或黑色墨水钢笔直接答在答题卡上。答在试题卷上无效。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com