
18.(12分):资料卡片:

研究小组根据上述信息设计如图所示装置(图中衬垫、夹持和固定仪器均已略去),在实验室里制取氯磺酸获得成功。

已知:①浓盐酸的密度为1.19g·cm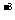 ;②浓硫酸的密度为1.84g·cm
;②浓硫酸的密度为1.84g·cm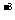 。沸点为338℃。试回答下列问题:
。沸点为338℃。试回答下列问题:
(1)实验开始前下列仪器中盛人的试剂或药品(填名称):B中为 ,C为 。
(2)A中的分液漏斗下端接有毛细管,其作用是 ;若不用毛细管,而直接用分液漏斗注入浓盐酸,可能发生的现象是 。
(3)写出C中发生反应的化学方程式: ;反应到一定程度时需用酒精灯对C装置加热,其目的是 。
(4)冷凝管中冷却水由 进入,从 流出(填字母)。
(5)F装置中加入的药品是 (填名称),其作用是 。
(6)将0.01 mol氯磺酸小心溶入水中制得50 mL溶液,再向溶液中加人50 mL0.4 mol/L NaOH溶液,充分反应后加水稀释至1000 mL,则稀释后溶液的pH= 。
17.(10分)利用如图所示的装置和其他必要的仪器用品,完成下列实验。

(1)证明氨气具有还原性。已知2NH3+3CuO N2+3Cu+3H2O。
N2+3Cu+3H2O。
①碱石灰的作用是 ,稀硫酸的作用是 。
②浓氨水与固体NaOH接触,为什么会逸出大量氨气?
。
③证明NH3具有还原性的实验现象是 。
(2)用吸收了足量尾气的溶液制取少量硫酸亚铁铵晶体。
已知:硫酸亚铁铵是淡蓝绿色晶体,在空气中性质比较稳定。硫酸亚铁铵在水中的溶解度小于硫酸铵、硫酸亚铁。制备硫酸亚铁铵的化学方程式为:(NH4)2SO4+FeSO4+6H2O==(NH4)2 Fe(SO4)2·6H2O。若溶液的pH>8.1,Fe外将转化为沉淀。
①吸收了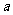 mol气体后,烧杯中的溶液能使酚酞变红。试依据“化学实验设计基本要求”设计制备硫酸亚铁铵溶液的方案,清简述实验方法。
mol气体后,烧杯中的溶液能使酚酞变红。试依据“化学实验设计基本要求”设计制备硫酸亚铁铵溶液的方案,清简述实验方法。
。
②为了从溶液中分离出硫酸亚铁铵晶体,还需要进行的实验操作是 。
16.恒温恒压下,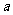 mol A和
mol A和 mol B在一个容积可变的容器中发生反应:A(g)+2B(g)
mol B在一个容积可变的容器中发生反应:A(g)+2B(g)  2C(g),一段时间后达到平衡,生成
2C(g),一段时间后达到平衡,生成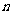 mol C。则下列说法中正确的是 ( )
mol C。则下列说法中正确的是 ( )
A.物质A、B的转化率之比为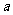 :
:
B.起始时刻和达平衡后容器中的压强比为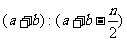
C.若起始时放人2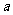 mol A和2
mol A和2 mol B,则达平衡时生成2n mol C
mol B,则达平衡时生成2n mol C
D.当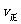 (A)=2
(A)=2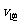 (B)时,可确定反应达平衡
(B)时,可确定反应达平衡
15.化合物A、B、C、D各由两种元素组成,甲、乙、丙是三种单质。这些常见的化合物与单质之间存在图所示关系(已知化合物C是一种有机物),以下结论不正确的是

A.上图所示的五个转化关系中,有三个是化合反应
B.上述转化关系所涉及的化合物中有一种是电解质
C.甲、乙、丙三种单质的晶体均是分子晶体
D.上图所示的五个转化关系中,均为放热反应
14.用Pt作电极,电解串联电路中分装在甲、乙两个烧杯中的200 mL0.3 mol/L NaCl的溶液和300 mL 0.2 mol/L的AgNO3溶液,当产生0.56L(标准状况)Cl2时停止电解,取出电极,将两烧杯溶液混合,混合液的pH为(假设:电解过程中电解产物不发生其他变化,混合后溶液的总体积为500ml。)
A.1.4 B.5.6 C.7 D.12.6
13.将等浓度的K2S溶液和NaHSO4溶液等体积混合,得到的溶液中离子浓度关系正确 的是
A.c(K+)>c(Na+)>c(H+)>c(OH )
)
B.c(Na+)+c(K+)+c(H+)=c(SO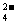 )+c(HS
)+c(HS )+c(OH
)+c(OH )+c(S2一)
)+c(S2一)
C.c(SO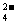 )>c(HS
)>c(HS )>c(OH
)>c(OH )>c(H+)
)>c(H+)
D.c(K+)+c(S2一)+c(H2S)+c(HS )+c(SO
)+c(SO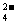 )
)
12.2005年中国防治禽流感药物的研究取得了重大突破,从中药材提取的金丝桃素对人工感染的H5N1亚型禽流感家禽活体具有良好的治愈率。已知金丝桃素的结构简式如图所示。 下列有关说法正确的是

A.金丝桃素的分子式为C17H22O3N
B.金丝桃素在一定条件下能与浓硫酸和浓硝酸的混合液反应
C.金丝桃素能在NaOH溶液中加热反应得到两种芳香族化合物
D.金丝桃素在一定条件下能发生加成、酯化、消去和氧化反应
11.下列化学用语表示正确的是
A.硫酸氢钾加热熔融的电离方程式:KHSO4==K++H++SO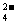
B.碳酸氢钾水解的离子方程式:HCO +H2O
+H2O H2CO3+OH
H2CO3+OH
C.钢铁发生电化腐蚀的正极反应式:4OH -4e
-4e ==2H2O+O2↑
==2H2O+O2↑
D.用石墨电极电解食盐水的阳极反应式:2C1 一2e
一2e ==Cl2↑
==Cl2↑
10.曲老师做了一个如下图所示的实验,发现烧杯中酸性KMnO4溶液褪色。若将烧杯中的溶液换成含有少量KSCN的FeCl2溶液,溶液显红色。判断下列说法中正确的是

A.该条件下生成的水分子化学性质比较活泼
B.该条件下H2被冷却为液态氢,液氢的水溶液具有还原性
C.该条件下H2燃烧生成了只具有氧化性的物质
D.该条件下H2燃烧的产物中可能含有一定量的H2O2
9.A、B、C为三种短周期元素,A、B在同周期,A、C的最低价离子分别为A 和C
和C ,离子半径A2一大于C
,离子半径A2一大于C ,B2+和C
,B2+和C 具有相同的电子层结构。下列判断正确的是
具有相同的电子层结构。下列判断正确的是
A.原子序数由大到小的顺序是C>A>B
B.原子半径由大到小的顺序是r(B)>r(A)>r(C)
C.离子半径由大到小的顺序是r(C )>r(B2+)>r(A2
)>r(B2+)>r(A2 )
)
D.原子核外最外层电子数由大到小的顺序是B>A>C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com