
21.(10分)图中A-J是与生命、环境、能源等问题有关的几种物质。试根据上述转化关系回答:

(1)反应①②共同具有的化学、生物意义是什么?
(2)从④的变化中,可知物质E在自然环境中所起的作用是 ;
(3)与H有关的环境公害是什么?列举导致这种公害的四大环境问题;
(4)⑤的离子方程式是 ,该反应的意义是什么?
。
(5)已知化学反应③可表示为(C6H10O5)n+I H↑+CH4↑+Q,请设想出这一总反应的实际价值和意义;
H↑+CH4↑+Q,请设想出这一总反应的实际价值和意义;
(6)在实现反应③的过程中,对中间产物乙醇进行发酵研究中,曾做过如下同位素示踪实验:2CH3CD218OT+14CO2 2CH3C18OOD+14CD2T2↑(方程式中“D”为“2H”,“T”为“3H”)?在同样反应条件下,试预测下列反应的产物:
2CH3C18OOD+14CD2T2↑(方程式中“D”为“2H”,“T”为“3H”)?在同样反应条件下,试预测下列反应的产物:
2CH3CH2OD+C18O2
4CH3CH(OH)CH3+14Cl8O2
(7)1997年美国三位科学家因发现物质E具有多种生理学功能而荣获诺贝尔生理学和医学奖,请问:物质E是 ,简述其生理作用: ;治疗心绞痛药物--硝化甘油之所以具有扩张血管的生理作用,就是由于硝化甘油在人体体液中酶的作用下缓缓氧化自发释放出E分子,同时生成CO2、H2O,写出该反应的化学方程式 。
20.(10分)已知A为酸式盐,B为某二价主族金属(其原子序数不超过20)的化合物,常温常压下C、D、F、G、I均呈气态,等物质的量A、B充分混合后加热能恰好完全反应,图中反应条件(除加热外)均已略去。
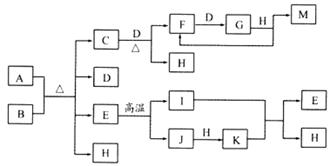
(1)写出A的化学式 ,B的电子式 。
(2)写出下列反应的离子方程式:
①在A溶液中加入M ;
②向A溶液中加入过量的NaOH溶液,并加热 。
(3)如对气体G进行加压操作,产生的现象是 ,
发生反应的化学方程式是 。
19.(8分)现有部分短周期元素的性质或原子结构如下表:
|
元素编号 |
元素性质或原子结构 |
|
T |
M层上有2对成对电子 |
|
X |
最外层电子数是次外层电子数的2倍 |
|
Y |
常温下单质为双原子分子,其氢化物水溶液呈碱性 |
|
Z |
元素最高正价是+7价 |
(1)元素T的原子最外层共有 种不同运动状态的电子。元素X的一种同位素可测定文物年代,这种同位素的符号是 。
(2)元素Y与氢元素形成一种离子YH ,写出该微粒的电子式:
(用元素符号表示)。
,写出该微粒的电子式:
(用元素符号表示)。
(3)元素Z与元素T相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是 。
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是 ,理由是
。
18.(12分)某种碱式碳酸铜,其组成可表示为:Cu2(OH)2CO3· H2O.在加热条件下,可以发生分解,化学方程式为:Cu2(OH)2CO3·
H2O.在加热条件下,可以发生分解,化学方程式为:Cu2(OH)2CO3· H2O
H2O 2CuO+CO2↑+(
2CuO+CO2↑+( )H2O。现取一定量(不称量其质量)该固体样品,先后完成两个实验:
)H2O。现取一定量(不称量其质量)该固体样品,先后完成两个实验:
实验(i):测定该碱式碳酸铜粉末组成中结晶水 的值;
的值;
实验(ii):用实验(i)结束后的残留固体完成乙醇的催化氧化并验证其反应产物。
请回答下列问题:
(1)用图中的仪器(必要的铁架台、铁夹、酒精灯等均在图中略去,橡皮塞可以在有孔、无孔之间替换)组装完成实验(i)的实验装置,组装时仪器按气流方向从左到右连接的顺序为
→ → → 。在这套装置中,干燥管的作用是
。

(2)若要用上图中的仪器组装完成实验(ii)的实验装置,组装时仪器也按气流方向从左到右连接的顺序为 → → → 。在这套装置中,干燥管的作用是
。
(3)在完成两个实验时,首先都必须先 ,然后在仪器 (填装置对应字 母)中加入碱式碳酸铜,乙醇放入仪器 (填装置对应字母)中。
(4)这两套装置中,在实验时需要加热的是 (填装置对应字母)。
(5)证明乙醇的催化氧化产物是乙醛的反应的化学方程式为 。
(6)这两套装置中,在实验前后均需要连同所盛试剂一起准确称量的仪器是 (填装置对应字母)。
17.(10分)请按要求填空。
(1)下列实验操作或对实验事实的描述不正确的是 (填序号)。
①用热的浓HCl洗涤附着有MnO2的试管:②用pH试纸测得氯水的pH为2;③测定硫酸铜晶体中结晶水含量的实验中,至少需经过4次称量;④将乙烯、乙炔分别通入溴水中,乙烯使溴水的褪色速度快;⑤蒸馏石油时,冷凝管中的冷水应上进下出;⑥向蛋白质溶液中加入浓的无机盐(如Na2SO4、CuSO4)溶液,可使蛋白质盐析而分离提纯;⑦在试管中放入几片碎滤纸,滴几滴90%的浓硫酸,再将滤纸捣成糊状,微热并冷却后先滴人几滴CuSO4溶液再加入过量的NaOH溶液加热至沸腾,可观察到红色沉淀生成;⑧配制一定浓度的溶液时,若定容时不小心加水超过容量瓶的刻度线,应立即用滴管吸去多余的部分。
(2)H2燃烧时除生成水外,还可生成少量的H2O2,但一般条件下很难得到H2O2;如果将H2燃烧时产生的火焰用冰块冷却,就可检验出极少量的H2O2生成。实验前,用两只蒸发皿盛好冰(用蒸馏水冷凝而成),做对比实验如下:
Ⅰ:一只蒸发皿放在石棉网上加热,使冰块慢慢熔化成液体,再加入0.1 mol/L碘化钾淀粉溶液,不显蓝色。
Ⅱ:另一只蒸发皿用调节好的氢气火焰对着冰块加热,熔化成液体后,再加入0.1mol/L碘化钾淀粉溶液,立即变成蓝色;
①一般条件下得不到H2O2的原因是 ;
②要做对比实验的理由是 ;
③为了增强实验效果,且能迅速检验出反应过程中生成H2O2,在不另加任何试剂和用品的情况下,你认为如何改进? ;
④ (填“能”或“不能”)将实验Ⅱ中的0.1 mol/L碘化钾淀粉溶液换成酚酞试剂;理由是 。
16.下列操作正确的是
A.中和滴定时,用标准溶液润洗滴定管,用待测溶液润洗锥形瓶
B.配制0.1mol/L NaOH溶液,将称量好的药品倒入容量瓶中,加水溶解,最后定容
C.苯酚沾在皮肤上立即用酒精擦洗
D.硫酸铜晶体结晶水含量测定时,需用小火缓慢加热,防止晶体飞溅
15.燃烧 g乙醇(液态)生成CO2气体和液态H2O。放出热量为Q kJ,经测定
g乙醇(液态)生成CO2气体和液态H2O。放出热量为Q kJ,经测定 g乙醇与 足量Na反应能生成H25.6L(标准状况下)。则表示乙醇燃烧热的热化学方程式是
g乙醇与 足量Na反应能生成H25.6L(标准状况下)。则表示乙醇燃烧热的热化学方程式是
A.C2H5OH(1)+3O2(g)==2CO2(g)+3H2O(1);△H=-Q kJ/mol
B.C2H5OH(1)+3O2(g)==2CO2(g)+3H2O(1);△H= Q kJ/mol
Q kJ/mol
C.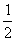 C2H5OH(1)+
C2H5OH(1)+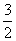 O2(g)==CO2(g)+
O2(g)==CO2(g)+ 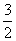 H2O (1);H△=-Q kJ/mol
H2O (1);H△=-Q kJ/mol
D.C2H5OH(1)+3O2(g)==2CO2(g)+3H2O(1);△H=-2Q kJ/mol
14.下列反应的离子方程式书写正确的是
A.除去KNO3溶液中的Fe3+:Fe3++3H2O Fe(OH)3++3H+
Fe(OH)3++3H+
B.氢氧化铁溶于氢碘酸中:Fe(OH)3+3H+ Fe3++3H2O
Fe3++3H2O
C.铁屑溶于过量稀硝酸:3Fe+8H++2NO
 -Fe2++2NO↑+4H2O
-Fe2++2NO↑+4H2O
D.将标准状况下112 mL的氯气通入10 mL1 mol/L的溴化亚铁溶液中:
2Fe2++4Br +3Cl2
+3Cl2 2Fe3++2Br2+6Cl
2Fe3++2Br2+6Cl
13.加热装有1 mol HI气体的定容密闭容器,发生如下反应:2HI(g) I2(g)+H2(g);AH>0,在
I2(g)+H2(g);AH>0,在 ℃反应达到平衡时,I2的物质的量分数为
℃反应达到平衡时,I2的物质的量分数为 ;若起始时在该容器中加入2 mol HI,在t2℃达到平衡时,I2的物质的量分数为
;若起始时在该容器中加入2 mol HI,在t2℃达到平衡时,I2的物质的量分数为 ,则下列关系正确的是
,则下列关系正确的是
A.若 ,则
,则 B.若
B.若 ,则
,则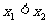
C.若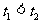 ,则
,则 D.若
D.若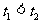 ,则
,则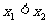
12.向FeI2溶液中不断通入Cl2,溶液中I 、I2、IO
、I2、IO 、Fe2+、Fe3+等粒子的物质的量随n(Cl2):n(FeI2)的变化可用下图简单表示,下列有关说法中正确的是
、Fe2+、Fe3+等粒子的物质的量随n(Cl2):n(FeI2)的变化可用下图简单表示,下列有关说法中正确的是

A.粗线5、细线3分别代表n(Fe3+)、n(IO )随n(Cl2):n(FeI2)变化的情况
)随n(Cl2):n(FeI2)变化的情况
B.假设通入Cl2的过程中溶液的体积不变,则溶液的pH始终不变
C.当n(Cl2):n(FeI2)=6.5时,溶液中n(Cl ):n(IO
):n(IO )=13
)=13
D.当n(Cl2):n(FeI2)=1.2时,离子方程式可表示为2Fe2++10I +6Cl2==5I2+2Fe3++12Cl
+6Cl2==5I2+2Fe3++12Cl
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com