
22.(10分)某同学为验证元素周期表中元素性质的递变规律,设计了如下系列实验。
Ⅰ.(1)将钠、钾、镁、铝四种颗粒大小相同的金属各1mol分别投入到足量的同浓度的盐酸中,试预测实验结果:反应最剧烈的是__________,反应最缓慢的是__________;产生气体最多的是____________。
(2)向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为___________________________。
Ⅱ.利用下图装置可验证同主族非金属性的变化规律
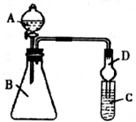
(3)仪器B的名称为___________,干燥管D的作用是____________。
(4)若要证明非金属性:Cl>Ⅰ,则A中加浓盐酸,B中加KMnO4(已知KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到混合溶液出现____________的现象,即可证明;若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液,观察到C中溶液出现___________的现象,即可证明。
(5)实验评价:证明非金属性Cl>Ⅰ时,从环境保护的观点考虑,此装置缺少尾气处理装置,可用_________溶液吸收尾气;证明非金属性C>Si时,由于盐酸具有挥发性会干扰实验验证,可用___________溶液除去。(上述两空均从下列试剂中选择最佳选项序号:a.NaOH溶液 b.饱和Na2CO3溶液 c.饱和NaHCO3溶液)
21.(6分)
(1)以铁、铜为电极,稀硫酸为电解质所构成的原电池中铁电极的电极反应式为_________,电路中每转移2mol电子生成标准状况下的气体体积为__________L。
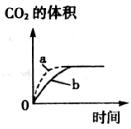
(2)在利用CaCO3与足量盐酸反应制取二氧化碳的反应中,生成二氧化碳的体积与反应时间的关系如图所示,两个实验所用的盐酸浓度相同,其中一个实验用的是块状石灰石,另一实验用的是石灰石粉末,则从图中可以看出:使用块状石灰石的是_________(填a或b)。
(3)已知淀粉在稀硫酸作催化剂、加热条件下能够水解,甲同学为检验淀粉水解产物设计了如下实验方案:
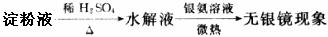
请分析其实验失败的原因:__________________________________,淀粉水解的化学方程式为________________________________________。
20.某铝热试剂由铝粉和铁的氧化物组成,二者在高温下恰好完全反应,得到的铁与原混合物中铝的物质的量之比为9:8,则铁的氧化物组成可能是
A.FeO B.Fe2O3 C.Fe3O4 D.FeO、Fe2O3的混合物
第Ⅱ卷(非选择题 共50分)
19.下表为元素周期表前四周期的一部分,下列有关X、W、Y、R、Z五种元素的叙述中正确的是

A.常温常压下,五种元素的单质都是气态
B.Y、Z的阴离子的电子层结构都与R原子的相同
C.X与Z的氢化物溶于水都显酸性
D.Y元素最高价氧化物对应水化物的浓溶液可以作为吸水剂
18.某学生用化学知识解决生活中的问题,下列家庭小实验不合理的是
A.用盐酸除去铁锈(主要成分为Fe2O3)
B.用米汤检验食盐中是否含碘酸钾(KlO3)
C.燃烧沼气(主要成分为甲烷)为炒菜提供热量
D.用灼烧并闻气味的方法区别纯棉织物和纯羊毛织物
17.设阿伏加德罗常数的值为NA,则下列说法正确的是
A.标准状况下,11.2L CCl4中含有的C-Cl键的数目为2NA
B.9.5gMgCl2中含有Cl2分子个数为0.1NA
C.0.1mol
 Br原子中含有的中子数为3.5NA
Br原子中含有的中子数为3.5NA
D.标准状况下,22.4L乙烯分子中含碳碳双键的数目为NA
16.下列有关方程式正确的是
A.实验室用液溴和苯在催化剂作用下制溴苯: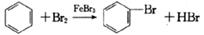
B.蛋壳溶于食醋:CaCO3+CH3COOH→CH3COOCa+H2O+CO2↑
C.煤的气化:C+H2O CO+H2
CO+H2
D.工业冶炼钠:Na2O+H2 2Na+H2O
2Na+H2O
15.下列各组性质的比较中,正确的是
A.碱性:Al(OH)3>Mg(OH)2>NaOH
B.原子半径:Na>Mg>A1
C.热稳定性:HI>HCl>HF
D.酸性:H3PO4>H2SO4>HClO4
14.2009年春季以来全球多国暴发甲型H1N1流感,莽草酸是一种治疗流感药物达菲的原料,其结构简式如图所示。下列关于莽草酸的说法正确的是

A.莽草酸不能与溴单质发生加成反应
B.1mol莽草酸能与4mol NaOH溶液反应
C.1mol莽草酸能与1mol乙醇发生酯化反应
D.1mol莽草酸能与足量金属钠反应产生4mol氢气
13.下图为铜锌原电池示意图,下列说法正确的是
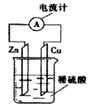
A.锌片为正极,逐渐溶解 B.烧杯中溶液变蓝色
C.电子由锌片通过导线流向铜片 D.该装置能将化学能转变为电能
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com