
4.下列微粒中,跟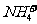 的电子总数和质子总数相同的是 ( )
的电子总数和质子总数相同的是 ( )
A.Ne B.F- C.CH4 D.H3O+
3.下列说法错误的是 ( )
A.食物放在冰箱中会减慢食物变质的速率
B.钾的金属性强,所以钾与水的反应比钠的反应剧烈
C.2mol SO2与1 mol SO2混合反应后一定能生成2mol SO3
D.面粉厂严禁烟火的原因是面粉粉尘表面积大,与空气接触遇明火极易发生爆炸
2.下列表达方式错误的是 ( )
A.甲烷的电子式 B.氟化钠的电子式样
B.氟化钠的电子式样
C.硫离子的结构示意图 D.碳-12原子
D.碳-12原子
1.提高资源的利用率、保护生态环境是每一个公民的责任的义务,下列做法与之相悖的是
( )
A.自2008年6月1日起,在全国范围内禁止生产、销售、使用超薄塑料购物袋
B.洗涤衣物时尽量使用含磷洗衣粉,以利于水生植物的生长
C.对煤进行气化或液化以获得洁净的燃料

D.采用“绿色化学”工艺,建立环境友好型化工体系
(二)在海水提镁的过程中如何实现对镁离子的分离?
(1)为了使镁离子沉淀下来,并充分利用当地的贝壳(主要成分为碳酸钙)资源,加入的足量试剂①是 (填化学式)。
(2)加入试剂①后,能够分离得到Mg(OH)2沉淀的方法是 (填标号字母)
A.蒸馏 B.过滤 C.萃取 D.分液
(3)加入的足量试剂②是 (填化学式)。
(4)写出由无水MgCl2制取金属镁的化学方程式 。
21.(10分)糖尿病是由于人体内胰岛素紊乱导致的代谢紊化综合症,以高血糖为主要标志。长期摄入高热量食品和缺少运动,都会导致糖尿病。
(1)血糖是指血液中的葡萄糖,下列有关说法正确的是
A.葡萄糖分子可表示为C6(H2O)6,则每个葡萄糖分子含有6个H2O
B.葡萄糖与果糖互为同分异构体
C.糖尿病人尿糖较高,可用新制的氢氧化铜来检测病人尿液中的葡萄糖
D.淀粉水解的最终产物是氨基酸
(2)木糖醇[结构简式为:CH2 OH(CHOH)3CH2OH]是一种甜味剂,糖尿病人食用后不会导致血糖升高。若用氯原子取代木糖醇分子中碳原子上的氢原子,得到的一氯代物有 种同分异构体。
(3)糖尿病人不可饮酒,酒精在肝脏内可转化成有机物A。A的实验结果如下:
①通过实验测得A的相对分子质量为60。
②A由C、H、O三种元素组成,分子中只存在两种类型的氢原子,且这两种类型的氢原子的个数比为1:3。
③A可与酒精在一定条件下生成有芳香气味的物质。
请设计实验证明A与碳酸的酸性强弱:向A溶液中加入 溶液,发现有气泡冒出;写出A与酒精反应的化学方程式 。
(4)糖尿病人宜多吃蔬菜和豆类食品,豆类食品中富有蛋白质。下列说法正确的是
。
A.蛋白质溶液遇碘物质会变蓝色
B.蛋白质可以通过烧焦时的特殊气味鉴别
C.人体内不含水解纤维素的酶,不能消化纤维素,因此蔬菜中的纤维素对人体没有用处
D.部分蛋白质溶液遇浓硝酸变黄,称为蛋白质的颜色反应
E.工业上常利用蛋白质的皂化反应来制取肥皂
22、(6分)A、B、C、D四种短周期元素,原子序数D>C>B>A,且B、C、D同周期,A、D同主族,B 原子的最外层只有一个电子,C的原子结构示意图为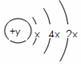 ,D在同周期元素中原子半径最小,据此填空:
,D在同周期元素中原子半径最小,据此填空:
(1)C元素的名称为 ,其气态氢化物的化学式为 。
(2)D在周期表的 周期, 族。
(3)A、B、C、D四种元素的原子半径由大到小的顺序为(用化学式填写)
(4)B的最高价氧化物的水化物的化学式为
(一)在海水提镁的过程中如何实现对镁离子的富集?
有三个学生提出自己的观点。
学生甲的观点:直接往海水中加入沉淀剂。
学生乙的观点:高温加热蒸发海水后,再加入沉淀剂。
学生丙的观点:利用晒盐后的苦卤水,再加入沉淀剂。
通过分析比较你认为学生 的观点正确(填学生序号),简述理由:
。
19.(8分)一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如下图,依图所示:

(1)该反应的化学方程式是_____________________。
(2)在图上所示的三个时刻中, (填t1、t2或t3)时刻处于平衡状态,此时V正 V逆(填>、<或=,);达到平衡状态后,平均反应速率v(N)﹕v(M)= 。
(3)若反应容器的容积不变,则“压强不再改变” (填“能”或“不能”)作为该反应已达到平衡状态的判断依据。
(4)已知M、N均为气体,则下列措施能增大反应速率的是 (选填字母)
A.升高温度 B.降低压强 C.减小M的浓度 D.将反应容器体积缩小
(5)向一个容积为4L的密闭容器中充入7molSO2和4molO2,在一定温度和压强下,发生如下反应:2SO2(g)+O2  2SO3(g),经4 s后达到平衡状态,测得SO2的物质的量是3mol,则以O2表示的反应速率为 ;平衡时SO3的物质的量浓度 。
2SO3(g),经4 s后达到平衡状态,测得SO2的物质的量是3mol,则以O2表示的反应速率为 ;平衡时SO3的物质的量浓度 。
20.(7分)目前世界上60%的镁是从海水中提取的,下图是某工厂从海水中提取镁的主要步骤。学生就这个课题展开了讨论。

学生就这个课题提出了以下问题:
18.(10分)2008年9月,三聚氰胺污染牛奶事件,在社会上造成了很坏的影响。牛奶和奶粉中添加三聚氰胺,主要是因为它能冒充蛋白质。已知三聚氰胺中含有碳、氢、氮三种元素,其相对分子质量为126,为测定三聚氰胺的组成,用下列各仪器装置(每个装置只能用一次),再过量的氧气流中将2.52g三聚氰胺样品氧化成CO2、H2O和N2。回答下列问题:

(1)产生的氧气按从左向右流向,所选装置的连接顺序为:
D接 、 、 、 、 。
(2)装置C的作用是 ,装置F中CuO的作用是 ;
(3)实验后称得A、B两装置的质量分别增加2.64g和1.08g,则三聚氰胺分子中碳、氢、氮的原子个数比为
(4)目前较多采用以尿素[(NH2)2CO]为原料,在0.1MPa下,390℃左右时,以硅胶做催化剂合成三聚氰胺。反应过程中,除生成CO2外,还生成一种使湿润的红色石蕊试纸变蓝的气体,试写出制备三聚氰胺的化学方程式(有机物可用分子式)
(5)按(1)的连接方法,此实验装置存在的缺陷是
17.(11分)某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用下图所示装置进行了有关实验:

(1)实验中他们取6.4g铜片和12mL 18mol·L 浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①请写出铜跟浓硫酸反应的化学方程式:______________________________。
②下列药品中能够用来证明反应结束后烧瓶中确有余酸的是 (填编号)。
A.铁粉 B.BaCl2溶液 C.银粉 D.Na2CO3溶液
③为什么有一定量的余酸但未能使铜片完全溶解,你认为原因是:
____ 。
(2)甲学生设计测定余酸的物质的量浓度的实验方案是测定铜与浓硫酸反应产生SO2的量,再计算余酸的物质的量浓度,他认为测定SO2的量的方法有多种,下列实验方案中不可行的是_____ __(填写字母编号)。
A.将装置A产生的气体缓缓通过预先称量过的盛有碱石灰的干燥管,结束反应后再次称量
B.将产生的气体缓缓通入足量酸性KMnO4溶液,再加入足量BaCl2溶液,过滤、洗涤、干燥、称量沉淀
C.用排水法测定装置A产生气体的体积(标准状况下)
D.用排饱和NaHSO3溶液的方法测出装置A产生气体的体积(标准状况下)
(3)乙学生设计测定余酸的物质的量浓度的实验方案是:测定反应后混合溶液中Cu2+的量。在反应后的溶液中加蒸馏水稀释至100mL,加入足量Na2S溶液,充分反应后过滤,再将沉淀洗涤、干燥、称量。
请写出生成沉淀的离子方程式:
(4)图中C是尾气处理装置,但常常产生倒吸现象,请你设计实验装置,防止倒吸现象的发生,在下图中补充完整:

16、将N2和H2以等物质的量充入一密闭容器中,在适当催化剂和恒温、恒压条件下反应。下列说法正确的是
A.达到化学平衡时,N2的正反应速率与H2逆反应速率相等
B.反应过程中,N2单质的体积分数始终为50%
C.达到化学平衡时,N2、H2在混合气体中的物质的量之比为1:1
D.达到化学平衡后,N2的正反应速率与NH3逆反应速率之比为2:1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com