
7.某种有机物A的分子式为C5Hl0O2,能发生水解反应,水解产物为Y和Z,同温同压下相同质量的Y和z的蒸气所占体积相同,则A的可能结构有
A.1种 B.2种 C.3种 D.4种
6.在120℃、1.01×105Pa时,将l L丙烷(C3H8)与若干升O2混合点燃充分燃烧后,恢复至原温度、压强,测得气体体积为m L,若通过碱石灰,气体体积变为n L,若m-n=7,则n L气体中一定含有:
A.O2 B.CO C.CO与O2 D:CO2
5.水解前与水解后的物质都能发生银镜反应的是
A.麦芽糖 B.蔗糖 C.乙酸乙酯 D.乙酸甲酯
4.已知在乙烯分子中有5个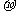 键、一个
键、一个 键,下列有关说法中正确的是
键,下列有关说法中正确的是
A.sp2杂化轨道形成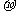 键、未杂化的2p轨道形成
键、未杂化的2p轨道形成 键
键
B.sp2杂化轨道形成 键、未杂化的2p轨道形成
键、未杂化的2p轨道形成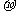 键
键
C.C-H之间是sp2-s形成的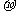 键,C-C之间只有未参加杂化的2p轨道形成的
键,C-C之间只有未参加杂化的2p轨道形成的 键
键
D.C-C之间是sp2-sp2形成的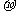 键,C-H之间是未参加杂化的2p轨道形成的
键,C-H之间是未参加杂化的2p轨道形成的 键
键
3.已知 有两种一氯取代物,则
有两种一氯取代物,则 的一氯取代物有
的一氯取代物有
A.3种 B.4种 C.6种 D.8种
2.上列各变化:①橡胶的硫化 ②石油的裂化 ③植物油的氢化 ④油脂的皂化 ⑤动物油的熔化 ⑥蔗糖的炭化 ⑦塑料的老化 其中属于化学变化的是
A.全部 B.②③④⑥⑦ C.①②⑧④⑤⑥ D.①②③④⑥⑦
1.下列基态原子或离子的电子排布式错误的是
A.Ca:ls22s22p63s23p64s2 B.Mg2+:1s22s22p6
C.F一:ls22s¨2p D.Br:1s22s22p63s23p63d1O4s24p5
22.(13分)一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g) FeO(s)+CO(g),已知该反应的平衡常数(K)与温度(T)的关系如图甲所示:
FeO(s)+CO(g),已知该反应的平衡常数(K)与温度(T)的关系如图甲所示:

(1)该反应的平衡常数表达式K=______________
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图乙所示。8min内,CO的平均反应速率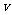 (CO)=___________mol/(L·min)。
(CO)=___________mol/(L·min)。
(3)下列措施中能使平衡时c(CO)/c(CO2)增大的是__________(填序号)。
A.升高温度 B.增大压强 C.充入一定量CO D.再加入一些铁粉
(4)铁及其化合物之间的相互转化可用下式表示:
Fe2+ Fe3+
Fe3+ FeO
FeO (高铁酸根离子)
(高铁酸根离子)
(a)Fe与过量稀硫酸反应可以制取FeSO4。若用反应所得的酸性溶液,实现上述①的转化,要求产物纯净。可选用的试剂是___________(选填序号);
A.Cl2 B.Fe C.HNO3 D.H2O2
(b)上述转化得到的硫酸铁可用于电化浸出黄铜矿精矿工艺。其中有一主要反应:
CuFeS2+4Fe3+=Cu2++5Fe2++2S。(CuFeS2中S为-2价)
则下列说法正确的是___________(选填序号);
A.从物质分类的角度看黄铜矿属于合金
B.反应中CuFeS2既作氧化剂又作还原剂
C.反应中所有铁元素均被还原
D.当转移1mol电子时,46 g CuFeS2参加反应
(c)高铁酸钠生产方法之一是在强碱性介质中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和水,该反应的离子方程式为_____________________________,高铁酸钠是一种新型、高效的绿色水处理剂,在水中发生反应生成Fe(OH)3。高铁酸钠作为水处理剂发挥的作用是_____________________、____________________。
21.(8分)为了测定一定质量的铜铝混合物中铜的质量分数,某化学课外活动小组设计了如下两个方案:
方案Ⅰ:铜铝混合物 测定生成气体的体积
测定生成气体的体积
方案Ⅱ:铜铝混合物 测定剩余固体的质量
测定剩余固体的质量
回答下列问题:
(1)小组成员一致认为两个方案都可行,你认为在实验室中选择方案________更便于实施。
(2)小组成员一致认为两个方案中可供选择的溶液A和B有很多,你认为在两个方案中溶液A和B均可选用的是____________。(填编号)
A.稀盐酸 B.氢氧化钠溶液 C.硫酸铜溶液
(3)小组成员为探究Cu2+、Al3+在溶液中是否可以依次转化为沉淀而析出,设计了如下实验:向含有0.01moLHNO3、0.001molCu(NO3)2、0.045molAl(NO3)3的溶液中逐滴加入一定浓度的NH3·H2O溶液,使混合溶液的pH值不断升高,当加至溶液的体积为45
mL时Al3+开始反应生成沉淀,当加至溶液的体积为50
mL时Cu2+开始反应生成沉淀。(不考虑溶液的体积变化)(常温下Ksp[Al(OH)3]=1.0×10 mol·L
mol·L ,ksp[Cu(OH)2]=2.0×10
,ksp[Cu(OH)2]=2.0×10 mol·L
mol·L 。)
。)
①Al(OH)3开始析出时溶液的pH为____________
②若溶液中离子的浓度约为1.0×10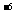 mol/L时可视为沉淀完全,则当Al(OH)3沉淀完全时Cu(OH)2是否析出?_________,理由_____________________________
mol/L时可视为沉淀完全,则当Al(OH)3沉淀完全时Cu(OH)2是否析出?_________,理由_____________________________
20.(10分)“西气东输”是西部开发的重点工程,这里的气是指天然气,其主要成分是甲烷。工业上将碳与水在高温下反应制得水煤气,水煤气的主要成分是CO和H2,二者的体积比为1:1。已知1 mol CO气体完全燃烧生成CO2气体放出283kJ热量:1mol氢气完全燃烧生成液态水放出286kJ热量;1mol CH4气体完全燃烧生成CO2气体和液态水放出890kJ热量。
(1)写出氢气完全燃烧生成液态水的热化学方程式
_____________________________________________________________________
(2)若1mol CH4气体完全燃烧生成CO2气体和水蒸气,放出的热量___890kJ(填>、=、<)
(3)忽略水煤气中其他成分,相同状况下若得到相等的热量,所需水煤气与甲烷的体积比约为_________(取简单整数比,下同);燃烧生成的CO2的质量比约为____________
(4)以上数据和计算说明,以天然气代替水煤气作用燃料,突出的优点是_____________
___________________________________________________________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com