
28.(21分)《化学反应原理》
A.(10分)随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。
(1)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:
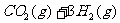

 ,
,
测得CO2和CH3OH(g)的浓度随时间变化如图所示
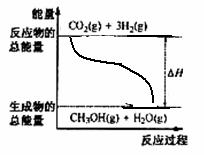
①从反应开始到平衡,氢气的平均反应速率 (H2)=
mol/(L·min)。
(H2)=
mol/(L·min)。
②该反应的平衡常数表达式为 。
③下列措施中能使 (CH3OH)/
(CH3OH)/ (CO2)增大的是
。
(CO2)增大的是
。
A.升高温度
B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离
D.再充入1mol CO2和3mol H2
(2)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2CO2=2 CO+O2,CO可用作燃料。
已知该反应的阳极反应为: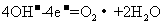
则阴极反应式为: 。
有人提出,可以设计反应 来消除CO的污染。请你判断是否可行并说出理由:
,
。
来消除CO的污染。请你判断是否可行并说出理由:
,
。
B.(11分)NaClO和KAl(SO4)2都是重要的化工产品,均可应用于造纸业。
(1) NaClO溶液pH>7,原因是(用离子反应方程式表示) 。
(2)根据NaClO性质推测,在纸浆中加入NaClO溶液的目的是 。
(3)在1 mol/L的KAl(SO4)2溶液中离子浓度由大到小的顺序是 。
(4)向NaClO饱和溶液中加入饱和KAl(SO4)2溶液,产生大量的白色胶状沉淀,此反应的离子方程式是 。
(5)若将
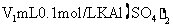 溶液和
溶液和 溶液混合。当产生沉淀物质的量最多时,V1:V2=
。(填写比例)
溶液混合。当产生沉淀物质的量最多时,V1:V2=
。(填写比例)
27.(19分)《综合化学实验》
黄铁矿是我国大多数硫酸厂制取硫酸的主要原料。某化学兴趣小组对某黄铁矿石(主要成分为FeS2)进行如下实验探究。
[实验一]为测定硫元素的含量
I.将m1 g该黄铁矿样品放入如下图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:

II.反应结束后,将乙瓶中的溶液进行如下处理:

[问题讨论]
(1)I中,甲瓶内所盛试剂是 溶液。乙瓶内发生反应的离子方程式有
、 。
(2)II中,所加H2O2溶液(氧化剂)需足量的理由是 。
(3)该黄铁矿中硫元素的质量分数为 。
[实验二]设计以下实验方案测定铁元素的含量
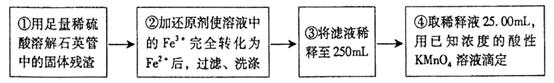
[问题讨论]
(4)③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有 。
(5)②中,若选用铁粉作还原剂,你认为合理吗?理由是: 。
(6)④中,请描述如何判断滴定操作已到达终点: 。
26.(18分)《有机化学基础》
某烃A的分子式为C6H12,已知其分子中所有的碳原子共平面,该分子的一氯取代物只有一种,回答下列问题:
(1)A的结构简式为 ;下列物质与A以任何比例混合,若总物质的量一定,充分燃烧消耗氧气的量相等的是(填序号) 。
(2)A与Br2的CCl4溶液反应生成B,B与NaOH的醇溶液共热可得到D,D分子中无溴原子。请写出由B制备D的化学反应方程式: 。
(3)B与足量NaOH水溶液完全反应,生成有机物E。
①E可能发生的反应类型有(填序号) 。
a.取代反应 b.消去反应 c.加聚反应 d.还原反应
②E与乙二醇的关系(填序号) 。
a.同分异构体 b.同一物质 c同系物 d.同素异形体
(4)E与乙二酸在一定条件下生成分子为C8H12O4的有机物,请写出该反应的化学方程式
(5)已知:
请写出E在酸性条件下生成G的化学反应方程式: 。与G的分子式相同,能发生银镜反应,且结构中有两个甲基的异构体共有 种,并请写出其中一种能发生银镜反应的化学方程式 。
14.莽草酸是一种合成治疗禽流感药物“达菲”的原料,鞣酸存在于苹果、生石榴等植物中。
下列关于这两种有机化合物的说法正确的是
A.两种酸都能与溴水发生加成反应
B.两种酸遇三氯化铁溶液都显色
C.鞣酸分子与莽草酸分子相比多了两个碳碳双键
D.等物质的量的两种酸与足量金属钠反应产生氢气的量相同
第II卷(非选择题共174分)
13.在一密闭容器中有如下反应:

 ;
; ,某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如下曲线图:
,某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如下曲线图:
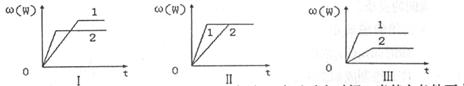
其中, (w)表示W在反应混合物中的百分含量,t表示反应时间。当其它条件不变时,
(w)表示W在反应混合物中的百分含量,t表示反应时间。当其它条件不变时,
下列分析正确的是
A.图I可能是不同压强对反应的影响,且
B.图II可能是在同温同压下催化剂对反应的影响,且1使用的催化剂效果好
C.图III可能是不同压强对反应的影响,且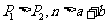
D.图III可能是不同温度对反应的影响,且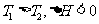
12.X、Y、Z、W为四种短周期主族元素。其中X、Z同族,Y、Z同周期,W与X、Y既不同族也不同周期;X原子最外层电子数是核外电子层数的3倍;Y的最高正价与最低负价的代数和为6.下列说法正确的是
A.Y元素最高价氧化物对应水化物的化学式为H2YO4
B.原子半径由小到大的顺序为: W<X<Z<Y
C.X与W可以形成W2X、W2X2两种氧化物
D.Y、Z两元素的气态氢化物中,Z的气态氢化物最稳定
11.某原电池构造如下图所示。下列有关叙述正确的是

A.在外电路中,电子由银电极流向铜电极
B.取出盐桥后,电流计的指针仍发生偏转
C.外电路中每通过0.1 mol电子,铜的质量理论上减小6.4 g
D.原电池的总反应式为Cu+2AgNO3=2Ag+Cu(NO3)2
10.下列各组单质中,前者能将后者从化合物中置换出来的是
①Al、Fe ②C、Si ③Mg、C ④H2、Cu
A.只有①③ B.只有②④ C.①②③④ D.只有①④
9.今有室温下四种溶液,①pH=11的氨水;②pH=11的NaOH溶液;③pH=3的醋酸;④pH=3的硫酸,下列有关说法不正确的是
A.①、②中分别加入适量的氯化铵晶体后,两溶液的pH均减小
B.分别加水稀释10倍,四种溶液pH ①>②>④>③
C.①、④两溶液混合后,若溶液呈中性,则所得溶液中2c(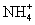 )=c(
)=c( )
)
D.V1L④与V2L②溶液混合后,若混合后溶液pH=4,则Vl:V2=11:9
8.下列关于化学观或化学研究方法的叙述中,错误的是
A.在化工生产中应遵循“绿色化学”的思想
B.控制实验条件可以改变化学反应的限度和速率
C.在元素周期表的金属和非金属分界线附近寻找半导体材料
D.根据元素周期律,由 可以类推氟元素也存在最高价氧化物的水化物HFO4
可以类推氟元素也存在最高价氧化物的水化物HFO4
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com