
27.(5分)现有部分短周期元素的性质或原子结构如下表:
|
元素编号 |
元素性质或原子结构 |
|
T |
M层上有2对成对电子 |
|
X |
最外层电子数是次外层电子数的2倍 |
|
Y |
常温下单质为双原子分子,其氢化物水溶液呈碱性 |
|
Z |
元素最高正价是+7价 |
(1)元素X的基态原子的轨道表示式: 。
(2)元素Y与氢元素形成一种离子YH4+,该粒子的中心原子Y的杂化类型是 。该粒子的空间构型为________________.
(3)元素Z与元素T相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是 。
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
26.(5分)1932年美国化学家鲍林首先提出了电负性的概念。电负性(用X表示)也是元素的一种重要性质,下表给出的是原子序数小于20的16种元素的电负性数值:
|
元素 |
H |
Li |
Be |
B |
C |
N |
O |
F |
|
电负性 |
2.1 |
1.0 |
1.5 |
2.0 |
2.5 |
3.0 |
3.5 |
4.0 |
|
元素 |
Na |
Mg |
Al |
Si |
P |
S |
Cl |
K |
|
电负性 |
0.9 |
1.2 |
1.5 |
1.7 |
2.1 |
2.3 |
3.0 |
0.8 |
请仔细分析,回答下列有关问题:
①预测周期表中电负性最大的元素应为___________(用元素符号表示);估计钙元素的电负性的取值范围为___________< X <___________;
②根据表中所给数据简述元素电负性X的大小与元素金属性、非金属性强弱关系________ ;
③经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。试推断AlI3中形成的化学键的类型为 _。
25.NA代表阿伏加德罗常数,下列说法正确的是
A.标准状况下,22.4LCHCl3中含有氯原子数目为3NA
B.7gCnH2n中含有的氢原子数目为NA
C.18 g D2O中含有的质子数目为10NA
D.1 L0.5mol/LNa2CO3 溶液中含有的CO32-数目为0.5NA
第II卷(非选择题 共40分)
24.现有四种元素的基态原子的电子排布式如下:① 1s22s22p63s23p4; ②1s22s22p63s23p3;③1s22s22p3; ④1s22s22p5。则下列有关比较中正确的是
A.第一电离能:④>③>②>① B.原子半径:④>③>②>①
C.电负性:④>③>②>① D.最高正化合价:④>③=②>①
23.下列关于丙烯(CH3-CH =CH2)的说法正确的是
A.丙烯分子有8个σ键,1个π键 B.丙烯分子中3个碳原子都是sp3杂化
C.丙烯分子有7个σ键,1个π键 D.丙烯分子中3个碳原子在同一直线上
22.向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续滴加氨水,难溶物溶解得到透明溶液。下列对此现象说法正确的是
A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变
B.沉淀溶解后,生成无色的配合离子[Cu(NH3)4]2+
C.向反应后的溶液加入乙醇,溶液没有发生任何变化
D.在[Cu(NH3)4] 2+离子中,Cu2+提供空轨道,NH3给出孤对电子,形成配位键
21.与NO3-互为等电子体的是
A. B.
B.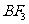 C.
C. D.
D.
20.下列说法中正确的是:
A.随原子序数的递增,第三周期元素的电负性逐渐减小
B.同主族元素原子的第一电离能从上到下逐渐减小
C.在所有的元素中,氟的第一电离能最大
D.在所有的元素中,锂的电负性最小
19.下列有关物质性质的比较顺序中,正确的是
A.热稳定性:HF<HCl<HBr<HI B.还原性:F-<Cl-<Br-<I -
C.酸性:HClO4>H2SO4>H3PO4>H2SiO3 D.熔点:HF<HCl<HBr<HI
18.下列各组微粒,半径大小比较中正确的是
A.K+ >Na+ >Li+ B.S2->Mg2+>Cl- C.Mg2+>Na+>F- D.Cl->F->F
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com