
5.下列推断合理的是 ( )
A.明矾[KAl(SO4)2•12H2O]在水中能形成Al(OH)3胶体,可用作净水剂
B.金刚石是自然界中硬度最大的物质,不可能与氧气发生反应
C.浓H2SO4有强氧化性,常温下能与Cu发生剧烈反应
D.将SO2通入品红溶液,溶液褪色后加热恢复原色;将SO2通入溴水,溴水褪色后加热也能恢复原色
4.下列离子方程式与所述事实相符且正确的是 ( )
 A.漂白粉溶液在空气中失效:ClO-+CO2+H2O
A.漂白粉溶液在空气中失效:ClO-+CO2+H2O HClO+HCO3-
HClO+HCO3-
 B.用浓盐酸与MnO2反应制取少量氯气:
B.用浓盐酸与MnO2反应制取少量氯气:
MnO2+2H++2Cl- Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
 C.向NaAlO2溶液中通入过量CO2制Al(OH)3:
C.向NaAlO2溶液中通入过量CO2制Al(OH)3:
AlO2-+CO2+2H2O Al(OH)3↓+HCO3-
Al(OH)3↓+HCO3-
 D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:
D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:
3ClO-+2Fe(OH)3 2FeO42-+3Cl-+H2O+4H+
2FeO42-+3Cl-+H2O+4H+
3.已知NaCl的摩尔质量为58.5 g·mol-1,其晶体密度为d g·cm-3,若下图中钠离子与最接近的氯离子的核间距离为a cm,那么阿伏加德罗常数的值可表示 ( )
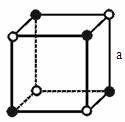
A.117a3d B.58.5/(2a3d) C.234/(a3d) D.58.5/(4a3d)
2.警犬常从案发现场的人体气味来获取有用线索。人体气味的成分中含有以下化合物: ①辛酸;②壬酸;③环十二醇;④5,9-十一烷酸内酯;⑤十八烷;⑥己醛;⑦庚醛。下列说法正确的是 ( )
A.①②⑥分子中碳原子数小于10,③④⑤分子中碳原子数大于10
B.①②是无机物,③⑤⑦是有机物
C.①②⑥⑦都是酸性化合物
D.②③④含氧元素,⑤⑥⑦不含氧元素
1.下列说法不正确的是 ( )
A.从海带中提取碘单质的过程涉及氧化还原反应
B.往淡水中加入NaCl等配成人造海水,可用于海产品的长途运输
C.赤潮主要是由工农业生产和生活废水引起沿海水域的富营养化而造成的
D.海洋经济专属区的资源开发可获得Fe、Co、K、Au、Mg、B等金属
30.(8分)C70分子是形如椭球状的多面体,该结构的建立基于以下考虑:
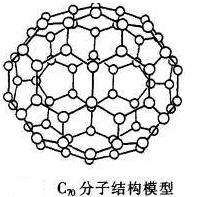
①C70分子中每个碳原子只跟相邻的3个碳原子形成化学键;
②C70分子中只含有五边形和六边形;
③多面体的顶点数、面数和棱边数的关系遵循欧 拉定理:顶点数+面数-棱边数=2。根据以上所述确定:
(1)C70分子中所含的单键数和双键数;
(2)C70分子中的五边形 个,六边形 个。
29.(14分) U、V、W、X、Y、Z是原子序数依次增大的六种常见元素。Y的单质在W2中燃烧的产物可使品红溶液褪色。Z和W元素形成的化合物Z3W4具有磁性。U的单质在W2中燃烧可生成UW和UW2两种气体。X的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体。请回答下列问题:
(1)V的单质分子的结构式为____________;XW的电子式为_____________;
Z元素在周期表中的位置是_____周期______族。
(2)U元素形成的同素异形体的晶体类型可能是(填序号)__________
①原子晶体 ②离子晶体 ③分子晶体 ④金属晶体
(3)U、V、W形成的10电子氢化物中,U、V的氢化物沸点较低的是(写化学式) __________;
V、W的氢化物分子结合H+能力较强的是(写化学式)__________,用一个离子方程式加以证明__________________________________________________。
(4)YW2气体通入BaCl2和HNO3的混合溶液,生成白色沉淀和无色气体VW,有关反应的离子方程式为___________________________________________________ ,
。
由此可知VW和YW2还原性较强的是(写化学式)____________。
28.(8分)
(1)前三周期元素中第一电离能最小的是___________(填元素符号),其基态原子的电子排布式为______________________。第二周期非金属元素形成的氢化物中化学键极性最大的是__________(填分子式),该物质在CCl4中的溶解度比在水中的溶解度_______ (填“大”或“小”)。
(2)物质形成分子间氢键和分子内氢键对物质性质的影响有显著差异。根据下表数据,形成分子间氢键的物质是___________ (填物质字母代号)。
|
代号 |
物质 |
结构简式 |
水中溶解度/g(25℃) |
熔点/℃ |
沸点/℃ |
|
A |
邻-硝基苯酚 |
 |
0.2 |
45 |
100 |
|
B |
对-硝基苯酚 |
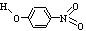 |
1.7 |
114 |
295 |
(3)晶格能的大小:MgO___________NaCl,键能的大小:HBr___________HI。(填“>”、“=”或“<”)
(4)下列物质的熔点高低顺序,正确的是___________
A.金刚石>晶体硅>二氧化硅>碳化硅
B.CI4>CBr4>CCl4>CH4
C.SiF4>NaF>NaCl>NaBr
27.(12分)氮化钠(Na3N)是科学家制备的一种重要的化合物,它与水作用可产生NH3。请回答下列问题:
(1)Na3N的电子式是_________,该化合物是由_________键形成。
(2)Na3N与水的反应属于_________反应。
(3)Na3N与盐酸反应生成_________种盐,其电子式是_________。
(4)比较Na3N中两种微粒的半径:r(Na+)_________r(N3-)(填“>”、 “=”、“<”)
26.(8分)某离子晶体晶胞结构如下图所示,X位于立方体的顶点,Y位于立方体中心。试分析:
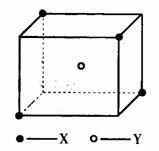
(1)晶体中每个Y同时吸引着__________个X,每个X同时吸引着__________个Y,该晶体的化学式为__________ 。
(2)晶体中在每个X周围与它最接近且距离相等的X共有__________个。
(3)晶体中距离最近的2个X与1个Y形成的夹角∠XYX的度数为__________。
(4)设该晶体的摩尔质量为M g·mol-1,晶体密度为ρg·cm-3,阿伏加德罗常数为NA则晶体中两个距离最近的X中心间的距离为__________ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com