
20.下列有关沉淀溶解平衡的说法正确的是
A.KSP(AB2)小于KSP (CD),则AB2的溶解度小于CD的溶解度
B.在氯化银的沉淀溶解平衡体系中,加入蒸馏水,氯化银的KSP增大
C.在氯化银的沉淀溶解平衡体系中,加入碘化钾固体,氯化银沉淀可转化为碘化银沉淀
D.在碳酸钙的沉淀溶液平衡体系中,通入CO2气体,溶解平衡不移动
第Ⅱ卷 非选择题 (共40分)
19.一定温度下,在某固定容积的密闭容器书发生可逆反应:A(g)+3B(g) 2C(g),能标志该反应达到平衡的是
2C(g),能标志该反应达到平衡的是
A.A、B、C的浓度之比为l:3:2
B.单位时间内生成n molA的同时生成3n molB
C.单位时间内生成n molA的同时生成2n molC
D.混合气体的密度不变
17.如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧口杯中央滴入浓的CuSO4溶液,一段时间后,下列有关杠杆的偏向(实验过程中,不考虑铁丝反应及两球的浮力变化)的判断正确的是
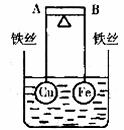
A.杠杆为导体和绝缘体时,均为A端高B端低
B.杠杆为导体和绝缘体时,均为A端低B端高
C.当杠杆为绝缘体时,A端低,B端高;为导体时,A端高,B端低
D.当杠杆为绝缘体时,A端高,B端低;为导体时,A端低,B端高
l8.向水中加入下列物质,其中能使水的电离程度增大的是
A.NaCl B.NH4C1 C.HCl D.NaOH
16.下列各组离子,一定能大量共存的是
A.常温下,c(H+)/c(OH-)=1×10-12的溶液:I-、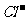 、
、 、Na+
、Na+
B.含有大量Fe3+的溶液:Na+、 、
、 、
、
C.加入铝粉能产生氢气的溶液: 、K+、
、K+、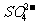 、
、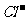
D.由水电离出的c(H+)=1×10-12mol/L溶液中:K+、Cl-、 、Na+
、Na+
15.下列各溶液中,微粒的物质的量浓度关系正确的是
A.0.1mol·L-1Na2CO3溶液中:
c(OH-)=c(HCO3-)+c(H+):+c(H2CO3)
B.0.1mol·L-1NH4Cl溶液中:c(NH4+)=c(Cl-)
C.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液中:
c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
D.向硝酸钠溶液中滴加稀盐酸得到pH=5的混合溶液中:
c(Na+)=c(NO3-)
14.在理论上不能用于设计原电池的化学反应是
A.H2SO4(aq)+BaCl2(aq)=2HCl(aq)+BaSO4(s);△H<0
B.CH3CH2OH(l)+3O2(g)  2CO2(g)+3H2O(l);△H<0
2CO2(g)+3H2O(l);△H<0
C.4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s);△<0
D.3Cu(s)+8HNO3(aq)=3Cu(NO3)2(aq)+2NO(g)+4H2O(l);△H<0
13.设阿伏加德常数为NA,则下列说法正确的是
A.常温常压下,11.2L甲烷中含有的氢原子数为2NA
B.标准状况下,0.3mol二氧化硫中含有氧原子数为0.3NA
C.常温下,2.7g铝与足量的盐酸反应,失去的电子数为0.3NA
D.常温下,1L0.1mol·L-1AlCl3溶液中含Al3+数一定为0.1NA
12.室温时,下列混合溶液的pH一定小于7的是
A.pH=3的盐酸和pH=11的氨水等体积混合
B.pH=3的盐酸和pH=11的氢氧化钠溶液等体积混合
C.pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合
D.pH=3的盐酸和pH=11的氨水等体积混合
11.下列溶液肯定呈酸性的是
A.含有H+的溶液 B.c(H+)=1×10-6 mol/L的溶液
C.c(H+)>c(OH-)的溶液 D.pH<7的溶液
10.室温下,在pH=12的烧碱稀溶液中,由水电离的c(OH-)为
A.1.0×10-7mol/L B.1.0×10-6 mol/L
C.1.0×10-2 mol/L D.1.0x 10-12 mol/L
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com