
32.(10分)KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯。其变化可表述为:
□KClO3+□HCl(浓) ― □KCl +□Cl2↑+□ClO2↑+□
(1)配平化学方程式并标出电子转移的方向和数目(未知物化学式和系数填入框内)
(2)浓盐酸在反应中显示出来的性质是_______(填写编号,多选倒扣)。
①只有还原性 ②还原性和酸性
③只有氧化性 ④氧化性和酸性
(3)产生0.1molCl2,则转移的电子的物质的量为_________。
(4)ClO2具有很强的氧化性。因此,常被用作消毒剂,其消毒的效率(以单位物质的量得到的电子数表示)是Cl2的_______倍。
31.(10分)提示:某些金属氧化物跟熔融烧碱反应可生成盐。根据以下化学反应框图填空:
(1)单质F是_________________ ____。
(2)写出由E生成G的离子反应方程式(或化学方程式)__________ ______。
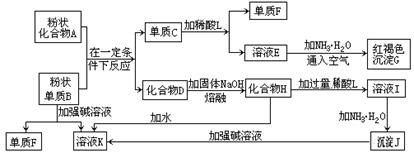
(3)溶液I中所含金属离子是_____________________。
(4) 由C→ E + F若改用浓酸,则不能选用的浓酸是(写分子式)__________、__________。
30.向50mL 18 mol/L H2SO4溶液中加入足量的铜片并加热,充分反应后,被还原的H2SO4的物质的量 ( )
A.小于0.45 mol B.等于0.45 mol
C.在0.45 mol和0.90 mol之间 D.大于0.90 mol
第Ⅱ卷(非选择题:4小题,共40分)
29.将分别盛有熔融的氯化钾、氯化镁、氧化铝的三个电解槽串联,在一定条件下通电一段时间后,析出钾、镁、铝的物质的量之比为 ( )
A.1:2:3 B.3:2:1 C.6:3:1 D.6:3:2
28.下列离子方程式正确的是 ( )
|
B.明矾溶液中加入氢氧化钡溶液,使其产生沉淀的物质的量达最大值:
Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O
C.Mg(HCO3)2溶液中加入过量石灰水:
Mg2++2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+MgCO3↓
D.向100 mL 0.1 mol/L的FeBr2溶液中通入0.012 mol Cl2:
10Fe2++14Br-+12Cl2=10Fe3++7Br2+24Cl-
27.对于反应4FeS2+11O2
 2Fe2O3+8SO2,下列叙述正确的是 ( )
2Fe2O3+8SO2,下列叙述正确的是 ( )
A.铁和硫两种元素被还原 B.只有硫元素被氧化
C.转移电子总数是44e- D.Fe2O3为氧化产物,SO2为还原产物
26.下表中物质的分类组合完全正确的是 ( )
|
编号 |
A |
B |
C |
D |
|
强电解质 |
Ba(OH)2 |
盐酸 |
HClO4 |
BaSO4 |
|
弱电解质 |
HI |
CaCO3 |
HClO |
NH3·H2O |
|
非电解质 |
SO2 |
NH3 |
Cl2 |
乙醇 |
25.根据下列四个反应方程式判断:氧化性由强到弱的顺序正确的是 ( )
①2 A-+B 2 ==== 2 B-+A 2 ②2 A-+C 2 ==== 2 C-+A 2
③2 B-+C 2 ==== 2 C-+B 2 ④2C-+D 2 ==== 2 D-+C2
A.D 2>C 2>B 2>A 2 B.A 2>B 2>C 2>D 2
C.C2>A 2>B 2>D 2 D.B 2>D 2>C 2>A 2
24.已知A物质的分子结构简式如下: ,1mol A与足量的NaOH溶液混合共热,充分反应后最多消耗NaOH的物质的量为 ( )
,1mol A与足量的NaOH溶液混合共热,充分反应后最多消耗NaOH的物质的量为 ( )
A.6mol B.7mol C.8mo1 D.9mo1
23.0.1mol/LNaOH溶液和0.1mol/LNH4Cl溶液等体积混合后,溶液中离子浓度大小顺序正确的是 ( )
A.c(Na+)>c(Cl-)>c(OH-)>c(H+)
B.c(Na+)=c(Cl-)>c(H+)>c(OH-)
C.c(Na+)=c(Cl-)>c(OH-)>c(H+)
D. c(Cl-)>c(Na+)>c(OH-)>c(H+)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com