
23.(6分)将5.1g镁铝合金溶于60mL 5mol·L-1的H2SO4溶液中,完全溶解后再加入65mL 10.0mol·L-1 的NaOH溶液,得到沉淀的质量为9.7g,继续滴加NaOH溶液时沉淀会减少。
(1)当加入 mL NaOH溶液时,可使溶液在硫酸中的Mg和Al恰好完全沉淀。
(2)计算合金溶于硫酸时所产生的氢气在标准状况下的体积。
22.(16分)铝镁合金已成为飞机制造、化工生产等行业的重要材料。研究性学习小组的同学,为测定某含镁3%-5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究。填写下列空白。
[方案一]
[实验方案]将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。
实验中发生反应的化学方程式是 。
[实验步骤]
(1)称取5.4g铝镁合金粉末样品,溶于V mL 2.0 mol/L NaOH溶液中。为使其反应完全,则NaOH溶液的体积V ≥ 。
(2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将
(填“偏高”、“偏低”或“无影响”)。
[方案二]
[实验方案]将铝镁合金与足量稀硫酸溶液反应,测定生成气体在通常状况(约20℃,1.01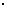 105Pa)的体积。
105Pa)的体积。
[问题讨论](1)同学们拟选用下列实验装置完成实验:

①你认为最简易的装置其连接顺序是:A接( )( )接( )( )接( )(填接口字母,可不填满。)
②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,一会儿后稀硫酸也不能顺利滴入锥形瓶。请你帮助分析原因 。
③实验结束时,在读取测量实验中生成氢气的体积时,你认为合理的是 。
A.待实验装置冷却后再读数
B.上下移动量筒F,使其中液面与广口瓶中液面相平
C.上下移动量筒G,使其中液面与广口瓶中液面相平
D.视线与凹液面的最低点水平读取量筒中水的体积
(2)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:稀硫酸 滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。于是他们设计了下图所示的实验装置。
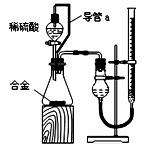
①装置中导管a的作用是
。
②实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL。则产生氢气的体积为__________mL。
21.(6分)混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化:

据此判断:
(1)固体B所含物质的化学式为 。
(2)固体E所含物质的化学式为 。
(3)反应①的离子方程式为 。
20.(10分)将2.5g碳酸钠、碳酸氢钠和氢氧化钠的固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol·L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如下图所示:

(1)写出OA段所发生反应的离子方程式 、 。
(2)当加入35mL盐酸时,产生CO2的体积为 mL(标准状况)。
(3)原混合物中NaOH的质量为 g,碳酸钠的质量分数为 。
19.(8分)某无色透明溶液与铝反应放出H2,该溶液中可能含有大量的:H+、K+、Mg2+、Cl-、OH-、NO3-、CO32-等离子,试推断:
第一种情况:一定有________________离子,可能有_______________________离子。
第二种情况:一定有________________离子,可能有_____________________离子。
30.(18分)芳香族化合物A1和A2分别和浓 在一定温度下共热产生的有机产物都只有烃B,B的蒸气密度是同温同压下
在一定温度下共热产生的有机产物都只有烃B,B的蒸气密度是同温同压下 密度的59倍,在催化剂存在一,B的一元硝化产物有三种。有关物质之间的转化关系如下:
密度的59倍,在催化剂存在一,B的一元硝化产物有三种。有关物质之间的转化关系如下:

(1)反应②属于 反应,反应④属于 反应。(填反应类型)
(2)写出下列两种物质的结构简式:A2 ;X
(3)写出下列反应的化学方程式:
②
④
(4)化合物E有多种同分异构体,其中属于酯类且苯环上有两个对位取代基的同分异
构体有四种,除 外,其余两种是:
外,其余两种是:
、 。
29.(16分)化学反应过程中总是伴随着能量的变化。
(1)反应A(g)+B(g) C(g)+D(g)过程中的能量变化如下图所示,
C(g)+D(g)过程中的能量变化如下图所示,

请回答:
①该反应的△H= ;
②当该反应处于平衡状态时,保持其它条件不变,下列措施中可以同时提高A、B两种反应物平衡转化率的有(填字母) ,对反应热不会产生影响的有 。
A.升高温度 B.降低温度 C.增大压强 D.减小压强
E.加入催化剂 F.移出生成物气体
(2)下列是298K时,氢气(H2)、碳(C)、辛烷(C8H18)、甲烷(CH4)燃烧的热化学方程式: (1);
(1);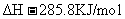
 ;△
;△
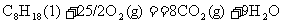 (1);
(1);
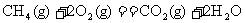 (1);
(1);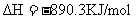
根据以上热化学方程式计算:相同质量的H2、C、C8H18、CH4充分燃烧时,放出热量最多的是 ,等质量的氢气和碳充分燃烧时放出热量的比值是 (保留1位小数)
(3)氢气、氧气不仅燃烧时能释放热能,二者形成的原电池还能提供电能。若用氢氧燃料电池电解由NaCl和CuSO4组成的混合溶液,其中
 取该混合液100mL用石墨做电极进行电解,通电一段时间后,在阴极收集到0.112L(标准状况)气体。请回答(写出第②问的计算过程):
取该混合液100mL用石墨做电极进行电解,通电一段时间后,在阴极收集到0.112L(标准状况)气体。请回答(写出第②问的计算过程):
①写出两极的电极反应式:阴极 ,阳极 。
②此时氢氧燃料电池中消耗 的质量是多少?
的质量是多少?
28.(13分)化学课外活动小组设计了如下图所示的一套气体发生、收集和尾气吸收装置,并按从左到右顺序连接以探究该装置的多功能性。



(1)甲同学认为利用装置Ⅱ可直接收集NH3、H2,但不能收集O2,理由是:
。
(2)乙同学认为装置Ⅰ可作为实验室氧气的快速发生器,对装置Ⅱ仅作改进后即可作为O2的收集装置,乙同学对装置Ⅱ的改时方法是: ;制O2时在装置Ⅰ的a加入 试剂,b仪器中加入 试剂。
(3)丙同学认为装置Ⅱ经乙改进后只需在装置Ⅱ之后再连一尾气吸收装置即可收集SO2气体。试将吸收SO2的尾气吸收装置画在下列方框中。

(4)丁同学认为利用装置Ⅰ和装置Ⅲ可进行验证Cl2氧化性比Br2强的实验。进行此项实验时在装置Ⅰ中的a仪器中加入 试剂b仪器中加入 试剂,装置Ⅲ中应加入 试剂,根据装置Ⅲ中观察到的 实验现象即可得出Cl2的氧化性比Br2强的结论。
27.(13分)某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
(1)已知在KBrO3在反应中得到电子,则该反应的还原剂是 ,1mol还原剂在反应中失去的原子数为 。
(2)已知0.2mol KBrO3在反应中得到1mol电子生成X,则X的化学式为 。
(3)根据上述反应可推知 。
A.氧化性:KBrO3>H3AsO4 B.氧化性:H3AsO4> KBrO3
C.还原性:AsH3>X D.还原性:X> AsH3
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目:
13.某有机物的结构简式为: ,1mol该有机物与足量的NaOH溶液在一定条件下充分反应,消耗的NaOH的物质的量为 ( )
,1mol该有机物与足量的NaOH溶液在一定条件下充分反应,消耗的NaOH的物质的量为 ( )
A.5mol B.4mol C.3mol D.2mol
第Ⅱ卷
第Ⅱ卷
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com