
30.(5分)水是生命之源,它与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。
(1)写出与H2O分子互为等电子体的微粒_ ________(填1种)。
(2)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述合理的是_ ____
A.氧原子的杂化类型发生了改变 B.微粒的形状发生了改变
C.氢原子的杂化类型发生了改变 D.微粒中化学键的类型发生了改变
(3)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是__ ___(请用相应的编号填写)
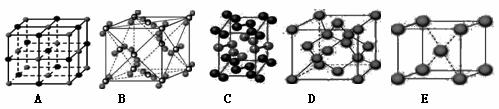
(4)已知冰的升华热是51 kJ/mol,水分子间的范德华力为11 kJ/mol,两者并不相等,原因是 。
29.(6分)随着科学技术的发展,阿佛加德罗常数的测定手段越来越多,测定的精度也越来越高。现有一种简单可行的测定方法,具体步骤为:
①将NaCl固体细粒干燥后,准确称取m gNaCl固体细粒并转移到定容仪器A中
②用滴定管向A仪器中加苯,不断振荡,继续加苯到A仪器的刻度,计算出NaCl固体的体积Vcm3。
⑴步骤①中仪器A最好使用 (填序号)
A.量筒 B.烧杯 C.容量瓶 D.试管
⑵步骤②中是否用酸式滴定管还是用碱式滴定管 ;
⑶能否用水代替苯: ;(填能或不能)
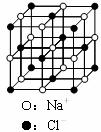
(4)在NaCl晶胞中,每个Na+同时吸引_______个 Cl-,且Na+数目和Cl-数目之比为___________。
(5)已知NaCl晶体中,靠得最近的Na+、Cl-间的距离为a cm(如下图),则用上述方法测得的阿佛加德常数NA的表达式为 。
28.(10分)处于相邻两个周期的主族元素A、B、C、D,它们的原子半径依次变小;A离子和B离子的电子层相差两层,且能形成BA2型的离子化合物;C的离子带3个正电荷且核外电子排布与氖相同;D气态氢化物的分子式为H2D,D在它的最高价氧化物中的质量分数是40%且D原子核中有16个中子。试回答:
(1)按要求填空:
A元素的名称 B元素的符号
C原子的外围电子排布式为 D的原子结构示意图
(2)B、C、D的第一电离能由大到小的顺序是: (填元素符号)
(3)A、B、C的电负性由大到小的顺序是: (填元素符号)
(4)A与B形成的化合物的电子式
(5)将C投入到的KOH溶液中现象为 ,相应的离子反应方程式为 。(2分)
27.(11分)化合物YX2、ZX2中,X、Y、Z的核电荷数小于18;X原子最外能层的p能级中有一个轨道充填了2个电子,Y原子的最外层中p能级的电子数等于前一能层电子总数,且X和Y具有相同的电子层数;Z与X在周期表中位于同一主族。回答下列问题:
(1)X的电子排布式为 ,Y的轨道表示式为 ;
(2)YX2的电子式是 ,分子构型为 ,中心原子发生了____杂化。
(3)Y与Z形成的化合物的分子式是_______,该化合物中化学键是________键(填“极性”或“非极性”),该分子属于__________分子(填“极性”或“非极性”)。
(4)Y的氢化物中分子构型为正四面体的是_______(填名称),键角为_______,中心原子的杂化形式为_______。
26.(6分)在HF、H2O、NH3、CS2、CH4、N2分子中:(填分子式)
(1)以非极性键结合的非极性分子是______________________。
(2)以极性键相结合,具有直线型结构的非极性分子是__________________________。
(3)以极性键相结合,具有三角锥结构的极性分子是_________________________。
(4)以极性键相结合,具有正四面体结构的非极性分子是_____________________。
(5)以极性键相结合,具有V形结构的极性分子是___________________________。
(6)以极性键相结合,而且分子极性最大的是___________________________。
25.下列说法中正确的是( )
A.外围电子构型为4f75d16s2元素在周期表中的位置是在第四周期第VIII族
B.在氢原子电子云图中通常用小黑点来表示电子的多少,黑点密度大则电子数目多
C.CsCl晶体中与每个Cs+ 距离相等且最近的Cs+共有6个;
D.金刚石立体网状结构中,最小的碳环上有4个碳原子且每个碳原子被6个碳环所共 用
24.X是核外电子数最少的元素,Y是地壳中含量最丰富的元素,Z在地壳中的含量仅次于Y,W可以形成自然界最硬的原子晶体。下列叙述错误的是( )
A.WX4是沼气的主要成分 B.固态X2Y是分子晶体
C.ZW是原子晶体 D.ZY2的水溶液俗称水玻璃
23.下列性质中,可以较充分说明某晶体是离子晶体( )
A.具有高的熔点 B.固态不导电,水溶液能导电
C.固态导电,可溶于水 D.固态不导电,熔融状态能导电
22.某物质的晶体中含Ca、Ti、O三种元素,其排列方式如下图所示,晶体中Ca、Ti、O的中原子个数之比依次为( )

A.1:1:3 B.2:3:1 C.2:2:1 D.1:3:3
21.下列说法中正确的是( )
A.原子晶体中只含有共价键,离子晶体中只含有离子键
B.原子晶体的熔点一定比金属晶体的高
C.分子晶体的熔点可能比金属晶体的高
D.任何晶体中,若含有阳离子就一定含有阴离子
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com