
9.化学与生活、社会密切相关。下列说法不正确的是
A.利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境
B.凡含有食品添加剂的食物对人体健康均有害,不可食用
C.为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术
D.提倡人们购物时不用塑料袋,是为了防止白色污染
4.(16分)
砷化镓属于第三代半导体,它能直接将电能转变为光能,砷化镓寿命是普通灯泡的100倍,而耗能只有其10%,推广砷化镓等发极管(LED)照明,是节能减排的有效举措,已知砷化镓的晶胞结构如下图。试回答下列问题
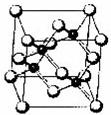
(1)下列说法正确的是________________(选填序号)。
A.砷化镓晶胞结构与NaCl相同 B.第一电离能:As>Ga
C.砷化镓的化学式为GaAs D.砷和镓都属于过渡元素
(2)ASH3的结构和性质与NH3相似,在AsH3分子As原子的杂化方式为______________AsH3分子的空间构型为_________________。
(3)写出Ga原子的基态原子的电子排布式_______________________
(4)AsH3的沸点_______________NH3的沸点(填>,<,或=),原因是:_________________
(5)预测砷化镓可能的晶体类型为_____________,简述理由___________。
3.(14分)Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
|
元素 |
Mn |
Fe |
|
|
|
I l |
717 |
759 |
|
电离能/ kJ.mo1-1 |
I 2 |
1509 |
1561 |
|
I 3 |
3248 |
2957 |
回答下列问题:
(1)Mn元素价电子的电子排布式为__________,比较两元素的I 2、I 3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难。对此,你的解释是_______________________
(2)Fe原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物。
①与Fe原子或离子形成配合物的分子或离子应具备的结构特征是________ :
②六氰合亚铁离子(Fe(CN)64-)中的配体CN-中C原子的杂化轨道类型是_________.写出一种与CN-互为等电子体的单质分子的电子式_____________:
(3)三氯化铁常温下为固体,熔点2820C,沸点3150C,在3000C以上易升华.易溶于水.也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁晶体为_______________
(4)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示。面心立方晶胞和体心立方晶胞中实际含有的Fe原子个数之比为_____________。

2.(10分)四种短周期元素A、B、C、D的性质或结构信息如下。
信息①原子半径大小:A>B>C>D
信息②四种元素之间形成的某三种分子的比例模型及部分性质如下:

甲:是地球上最常见的物质之一,是包括人类在内所有生命生存的重要资源,也是生物体最重要的组成部分。
乙:无色,无味而易燃,是21世纪的主要能源。
丙:有强氧化性,可以用于消毒杀菌。
请根据上述信息回答下列问题。
(1)甲、乙、丙中含有的共同元素是____________________ (填名称)。
(2)B元素在周期表中的位置______________,写出A原子的电子排布式_____________。
(3)上述元素的原子M层有一个未成对P电子数的是_____________(填元素符号)。
(4)B形成的单质晶体可能为_____________。
A.离子晶体 B.分子晶体 C.原子晶体 D.金属晶体
1.(8分)A-D是原子序数在20以内的元素,其性质或结构信息如下表:
|
元素 |
A |
B |
C |
D |
|
性质或结构信息 |
其单质是一种本身有毒又可用来消毒的有色气体 |
该元素在人体中累积超过一定量会造成老年痴呆症 |
原子核外P电子数比s电子数少l |
带二个单位负电荷的阴离子其核外电子层结构与Ar原 子相同 |
请根据表中的信息回答下列问题:
(1)A元素在元素周期表中的位置是________ ,B原子核外电子排布式为_______________。
(2)B和D形成的化合物只能用干法制取,其化学方程式是______________。
(3)C的单质特别稳定,原因在于_____;在C的氢化物的水溶液中存在的平衡是:_________。
(4)D的最高价氧化物对应水化物的浓溶液所具有的特性有:________、___________、________)
4.(10分)实验室某物质X的试剂瓶的标签严重破损,只能隐约看到如下部分:
 ,取该试剂瓶中的试剂,通过燃烧试验测得:0.1mol该物质完全燃烧得到39.6gCO2和9gH2O
,取该试剂瓶中的试剂,通过燃烧试验测得:0.1mol该物质完全燃烧得到39.6gCO2和9gH2O
(1)通过计算可知该有机物的分子式为______________,
(2)进一步试验可知:①该物质能与碳酸氢钠溶液反应生成元色无味气体;②0.1mol该物质与足量金属钠反应可生成氢气2.24L(已折算成标准状况);③该物质在浓硫酸加热条件下生成含两个六元环的酯类;④该物质能发生消去反应。则该物质的结构简式为__________。
(3)A经下列转化可以生成该物质,若取C在NaOH水溶液中反应后的混合液,加入足量硝酸酸化后.再加入硝酸银溶液,出现白色沉淀。

①A转化成B的反应类型为_________,写出化学方程式:______________________
②写出C发生水解反应的化学方程式:
_____________________________________________________________
3.(10分)原儿茶酸乙酯是一种食品添加剂,可用于油脂、奶油的防氧化,其结构简式为

(1)原儿茶酸乙酯经水解、分离、提纯,可以得到纯净的乙醇和原儿茶酸。已知酸性强弱顺序为:原儿茶酸>碳酸>苯酚,试写出原儿茶酸与NaHCO3。溶液反应的化学方程式:________________________________________ _________
(2)同时符合下列四个要求的原儿茶酸的同分异构体共有______________种。
①含有苯环;②能发生银镜反应;③在稀NaOH溶液中,1mol该同分异构体能与3 mo1NaOH发生反应;④只能生成一种一氯代产物。
(3)从(2)确定的同分异构体中任选一种,指定为下列框图中的A。回答下列问题:

①化学反应A→C的反应类型为:______________________________
②写出B+E→F的反应方程式:
______________________________________________________________
一种高分子化合物(Ⅵ)是目前市场上流行的墙面涂料之一,其合成路线如下(反应均在一定条件下进行):

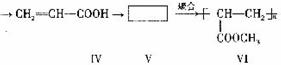
回答下列问题:
(1)目前工业上生产乙烯主要是以_____________为原料通过__________反应来实现。
(2)化合物Ⅲ生成化合物Ⅳ的副产物为________。(提示:该反应的逆反应原子利用率为l00%)
(3)写出合成路线中从化合物Ⅳ到化合物Ⅵ的两步反应方程式:(不要求标出反应条件)
_________________________________________________________________
(4)下列关于化合物Ⅲ、Ⅳ和V的说法中,正确的是__________(填字母)。
A.化合物Ⅲ可以发生氧化反应
B.化合物Ⅲ不可以与NaOH溶液反应
C.化合物Ⅳ能与氢气发生加成反应
D.化合物Ⅲ、Ⅳ和V均可与金属钠反应生成氢气
E.化合物Ⅳ和V均可以使溴的四氯化碳溶液褪色
F.化合物V可以发生水解反应
2.(16分)某有机物A的结构简式

(1)A的分子式为___________。
(2)A在NaOH水溶液中加热得B和C,是芳香族化合物,B和C的结构简式分别是 _____________、_______,该反应属于_____________。
(3)某同学对有机物A可能具有的化学性质进行了如下推测,其中错误的是( )
a.可以使酸性高锰酸钾溶液褪色 b.在一定条件下可以和浓硝酸反应
c.在一定条件下可以和乙酸反应 d.遇FeCl3溶液可以发生显色反应
(4)有机物A的同分异构体甚多,其中一类可以用通式 表示( X、Y均不为 氢),试写出上述通式含有羟基、且能发生银镜反应的三种物质的结构简式:
表示( X、Y均不为 氢),试写出上述通式含有羟基、且能发生银镜反应的三种物质的结构简式:
__________________,__________________,________________
11.(12分)有关元素A、B、C、D的信息如下:
|
元素 |
有关信息 |
|
A |
最高价氧化物对应的水化物(甲)能与其气态氢化物(乙)反应生成盐 |
|
B |
地壳中含量最高的元素,A与B可形成一种质量比为7:12的化合物(丙) |
|
C |
单质曾用于焊接钢轨 |
|
D |
单质是生活中常见金属,其制品在自然环境中被腐蚀呈现红棕色 |
请回答下列问题:
(1)用C单质来焊接钢轨的化学方程式是__________________。
(2)有关C与D元素,下列说法正确的是_________________(填序号)。
①C或D的高价盐均可用做净水剂
②用C或D单质做成的槽车,都可用来运输甲的稀溶液
③C、D的单质与稀硫酸组成的原电池,C电极发生氧化反应
④C的合金可用来做车船材料和门窗等
(3)B的一种氢化物在碱性溶液中可与丙反应,生成物中A元素只显其最高价态,该反应的离子方程式是___________。
(4)现取l mol/L 100 mL的C的氯化物溶液,向其中加入l mol/L氢氧化钠溶液产生了3.9g的沉淀,则加入的氢氧化钠溶液体积可能是_____________mL。
(5)已知:2AB2(g) A2B4(g);△H<0。在恒温恒容条件下,将一定量AB2和A2B4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示。
A2B4(g);△H<0。在恒温恒容条件下,将一定量AB2和A2B4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示。

①a、b、c、d四个点中,化学反应处于平衡状态的是_____________点。
②2.5 min时,增加了___________(填物质的化学式) __________mol。
③a、b、c、d四个点所表示的反应体系中,气体颜色由深到浅的顺序是_______(填字母)。
(1)合成氨工业对化学工业和国防工业具有重要意义。工业合成氨的原理是:N2+3H2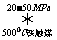 2NH3,△H<0,生产流程如下图所示。
2NH3,△H<0,生产流程如下图所示。
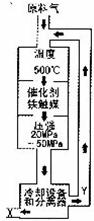
①X的化学式为_________;
②图中条件选定的主要原因是(选填字母序号)___________;
A.升高温度、增大压强均有利于氨的合成
B.铁触媒在该温度时活性大
C.工业生产受动力、材料、设备等条件的限制
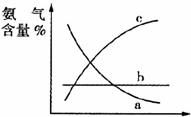
③改变反应条件,会使平衡发生移动。图表示随条件改变,氨气的百分含量的变化趋势。当横坐标为压强时,变化趋势正确的是____________(选填字母序号),当横坐标为温度时,变化趋势正确的是(选填字母序号)_________。
(2)常温下氨气极易溶于水,其水溶液可以导电。
④用方程式表示氨气溶于水且显弱碱性的过程:_____________________________
⑤氨水中水电离出的c(OH-___________10-7mol·L-1(填写“>”、“<”或“=”);
⑥将相同体积、相同物质的量浓度的氨水和盐酸混合后,溶液中离子浓度由大到小依次为__________________。
以下是选作题,从[有机化学基础][物质结构与性质]两个模块中任选一个模块作答。
10.一种新型燃料电池,一极通入乙烷,另一极通入氧气,电解质是KOH溶液。下列对此电池的说法正确的是
A.正极反应为C2H6+18OH-一14e-=2CO32-+12H2O
B.每消耗1mol C2H6,电池中就消耗4molKOH
C.放电一段时间后,正极周围的pH降低
D.电池的总反应是2 C2H6+5O2=2CO2+6H2O
第Ⅱ卷(非选择题,共70分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com