
22.(2分)已知 Cl2 + 2NaOH == NaCl + NaClO + H2O,现有瓶NaOH溶液,质量分数为14%( 其密度为1.14 g/ml)则这种溶液 升能与2.24升(标况下)Cl2恰好完全反应。
21.(2分)298K 100kPa时,NH3(g)+HCl(g)==NH4Cl(s) ΔH1=-176kJ·mol-1
N2(g)+3H2(g)==2NH3(g)ΔH2=-92.2 kJ·mol-1
H2(g)+Cl2(g)==2HCl(g)ΔH3=-184.6 kJ·mol-1
298K时的N2(g)+4H2(g)+Cl2(g)==2 NH4Cl(s) ΔH=
20.(8分)向一定量的浓硝酸里①加入过量的铜,开始反应发生的化学方程式
反应一段时间后,硝酸浓度会变稀,反应的离子方程式 反应中硝酸的作用是 和
②加入红热的碳,反应的化学方程式
19.(5分)①盛放氢氧化钠的试剂瓶不能用玻璃塞,原因是:(用离子方程式表示)
②工业上制造粗硅的反应是 氧化剂是
18.下列溶液中离子浓度关系表示正确的是
A.NaHCO3溶液中:
B.pH=3的CH3COOH与pH=11的NaOH溶液等体积混合后的溶液中: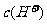 <
<
C.0.1mol/L的NH4Cl溶液中, >
>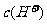 >
>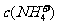 >
>
D.物质的量浓度相等的CH3COOH 和CH3COONa溶液等体积混合后的溶液中:

第Ⅱ卷(非选择题,共46分)
17.某学生设计了一个“黑笔写红字”的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。据此,下列叙述正确的是:

A.铅笔端作阳极,发生还原反应 B.铂片端作阴极,发生氧化反应
C.铅笔端有少量的氯气产生 D.a点是负极,b点是正极
16.一定温度下,可逆反应2NO2 2NO+O2,在体积固定的密闭容器中反应,达到平衡状态的标志是( )
2NO+O2,在体积固定的密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n mol O2,同时生成2n molNO2
②单位时间内生成n mol O2,同时生成2n molNO
③NO2、NO、O2的浓度比为2:2:1
④混合气体的压强不再改变
⑤混合气体的颜色不再改变
⑥混合气体的平均摩尔质量不再改变
A.①④⑤⑥ B.①②③⑤ C.②③④⑥ D.以上全部
15.酯类物质广泛存在于香蕉、梨等水果中。某实验小组先从梨中分离出一种酯,然后将分离出的酯水解,得到了乙酸和另一种化学式为C6H13OH的物质。对于此过程,以下分析中不正确的是( )
A.C6H13OH分子含有羟基
B.C6H13OH可与金属钠发生反应
C.实验小组分离出的酯可表示为CH3COOC6H13
D.不需要催化剂,这种酯在水中加热即可大量水解
14.下列哪些能说明醋酸是弱酸的事实( )
(1)醋酸不易腐蚀衣服
(2)0.1mol/L的CH3COONa溶液的pH约为9.
(3)进行中和滴定时,等体积等物质的量浓度的H2SO4溶液比等体积等物质的量浓度的CH3COOH溶液消耗的NaOH溶液多。
(4)0.1mol/L的CH3COOH溶液pH约为2.9。
(5)相同体积的PH均等于4的盐酸和CH3COOH溶液,被同一物质的量浓度的NaOH溶液中和,CH3COOH溶液消耗的NaOH溶液多。
(6)镁粉与一定量稀硫酸反应,如果向其中加入少量醋酸钠可以降低反应速率但不改变产生气体的总量。
A.(2)(4)(5)(6) B.(2)(3)(5)(6) C.(3)(4)(5)(6) D.全是
13.某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,平衡pH值随溶液体液体积变化的曲线如下图所示,据图判断正确的是:( )

A.Ⅱ为盐酸稀释的pH值变化图线
B.b点溶液的导电性比c点溶液的导电性强
C.a 点Kw的数值比c点Kw的数值大
D.b点酸的总浓度大于a点的总浓度
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com