
27.化学课上老师做了一个演示实验:用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来。
(1)由上述实验现象所得出的有关过氧化钠跟水反应的结论是:
第一:有氧气生成;
第二: 。
Na2O2跟水反应的化学方程式是 。
(2)某研究性学习小组拟用下图所示装置(气密性良好)进行实验,以证明上述结论。用以验证第一条结论的实验操作是:_________;用以验证第二条结论的实验方法是: 。
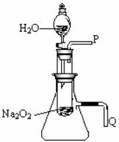
(3)实验(2)往试管中加水至固体完全溶解且不再有气泡生成后,取出试管,往试管中滴入酚酞试液,发现溶液先变红后褪色。为探究其原因,该小组同学从查阅有关资料中得知:Na2O2与水反应可生成H2O2,H2O2具有强氧化性和漂白性。请设计一个简单的实验,验证Na2O2跟足量水充分反应后的溶液中有H2O2存在。(只要求写出实验所用的试剂及观察到的现象)
试剂: ;现象: 。
(4)该小组同学提出用定量的方法探究Na2O2跟水反应后的溶液中否含有H2O2,其实验方法为:称取2.6g Na2O2固体,使之与足量的水反应,测量产生O2的体积并与理论值比较,即可得出结论。

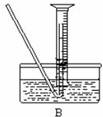
①测量气体体积时,必须待试管和量筒内的气体都冷却至室温时进行,应选用上图装置中的
(忽略导管在量筒中所占的体积) (填序号),理由是 。
②若在标准状况下测量气体的体积,应选用的量筒的大小规格为 (选填“100mL”“200 mL”“500 mL”或“1000 mL”)。
26.实验室制备溴乙烷(C2H5Br)的装置和步骤如下图:(已知溴乙烷的沸点38.4℃)
①检查装置的气密性,向装置图所示的U形管和大烧杯中加入冰水;
②在圆底烧瓶中加入10mL95%乙醇、28mL78%浓硫酸,然后加入研细的13g溴化钠和几粒碎瓷片;
③小心加热,使其充分反应。
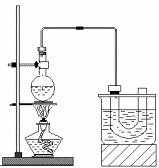
回答下列问题:
(1)该实验制取溴乙烷的化学方程式为: ___________________________________。
(2)反应时若温度过高,可看到有红棕色气体产生,该气体分子式为___________,同时生成的无色气体分子式为_______________。
(3)为了更好的控制反应温度,除用图示的小火加热,更好的加热方式是__________。
(4)U型管内可观察到的现象是_____________________________。
(5)反应结束后,U形管中粗制的C2H5Br呈棕黄色。为了除去粗产品中的杂质,可选择下列试剂中的_________________(填序号)。
A.NaOH溶液 B.H2O C.Na2SO3溶液 D.CCl4
所需的主要玻璃仪器是______________(填仪器名称)。要进一步制得纯净的C2H5Br,可用水洗,然后加入无水CaCl2,再进行_______________(填操作名称)。
(6)下列几项实验步骤,可用于检验溴乙烷中溴元素,其正确的操作顺序是:取少量溴乙烷,然后__________________(填代号)。
①加热; ②加入AgNO3溶液;
③加入稀HNO3酸化; ④加入NaOH溶液; ⑤冷却
25.在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
|
t℃ |
700 |
800 |
830 |
1000 |
1200 |
|
K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= 。
(2)该反应为 反应(选填吸热、放热)。
(3)能判断该反应是否达到化学平衡状态的依据是 (多选扣分)。
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ℃。
24.我国了“神舟”系列载人飞船的成功发射,标志着“炎黄子孙千年飞天梦想实现了”
(1)火箭升空时,由于与大气层的剧烈摩擦,产生高温。为了防止火箭温度过高,在火箭表面涂上一种特殊的涂料,该涂料的性质最可能的是 ( )
A.在高温下不融化 B.在高温下可分解气化
C.在常温下就分解气化 D.该涂料不可能发生分解
(2)火箭升空需要高能的燃料,经常是用N2O4和N2H4作为燃料,其反应的方程式是:
N2O4 + N2H4 → N2 + H2O 。
请配平该反应方程式:---N2O4 + ----N2H4 → ----N2 + ----H2O
该反应中被氧化的原子与被还原的原子物质的量之比是 。
这个反应应用于火箭推进器,除释放大量的热和快速产生大量气体外,还有一个很大的优点是 。
(3)为了向宇航员提供氧气,飞船上有专门的供氧装置。现有供氧剂过氧化钠与超氧化钾(KO2)。
①写出它们与二氧化碳反应的化学方程式(超氧化钾与二氧化碳的反应产物与过氧化钠类似):
__________________ ____;_________________________。
②你选择的供氧剂是: ,原因是:____________________________。
23.第一电离能I1是指气态原子X(g)处于基态时,失去一个电子成为气态阳离子X+(g)所需的能量。下图是部分元素原子的第一电离能I1随原子序数变化的曲线图(其中12号至17号元素的有关数据缺失)。
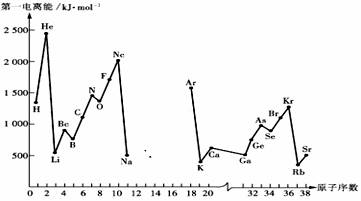
请回答以下问题:
(1)认真分析上图中同周期元素第一电离能的变化规律,推断Na--Ar元素中,Al的第一电离能的大小(最小)范围为 <Al< (填元素符号)。
(2)从上图分析可知,同一主族元素原子的第一电离能I1变化规律是______________;
(3)上图中第一电离能最小的元素在周期表中的位置是________________________;
(4)根据对角线规则,Be、Al元素最高氧化物水化物的性质相似,它们都具有 性,其中Be(OH)2显示这种性质的离子方程式是:___________ ___、__________。
(5)单质C不可能具有的性质是
A.具有良好的导电性 B.熔沸点很高
C.硬度较小 D.易与Br单质反应,形成的化合物分子是极性分子。
22.青石棉(cricidolite)是世界卫生组织确认的一种致癌物质,是《鹿特丹公约》中受限制的46种化学品之一,青石棉的化学式为:Na2Fe5Si8O22(OH)2,青石棉用稀硝酸溶液处理时,还原产物只有NO,下列说法正确的是 ( )
A.青石棉是一种易燃品且易溶于水
B.青石棉的化学组成用氧化物的形式可表示为:Na2O·3FeO·Fe2O3·8SiO2·H2O
C.1mol Na2Fe5Si8O22(OH)2与足量的硝酸作用,至少需消耗6L3mol/LHNO3溶液
D.1mol Na2Fe5Si8O22(OH)2与足量氢氟酸作用,至少需消耗5.5L2mol/LHF溶液
第Ⅱ卷(共84分)
|
21.将Zn和Cu用导线连接置于同一稀H2SO4溶液中,下列各叙述中正确的是 ( )
A.正极附近C(H+)逐渐增大
B.正极上产生气泡
C.正极、负极附近C(H+)基本不变
D.Zn片、Cu片同时冒出气泡,则说明Zn片不纯
20.分子式为C5H10O3的有机物,在一定条件下能发生如下反应:①在浓硫酸存在下,能分别与CH3CH2OH或CH3COOH反应;②在特定温度及浓硫酸存在下,能生成一种能使溴水褪色的物质;③在特定温度及浓硫酸存在下,还能生成一种分式为C5H8O2的五元环状化合物。则C5H10O3的结构简式为 ( )
A.HOCH2CH2COOCH2CH3
B.HOCH2CH2CH2CH2COOH
C.CH3CH2CH(OH)CH2COOH
D.CH3CH(OH)CH2CH2COOH
19.下列说法中正确的是(NA为阿伏加德罗常数) ( )
A.78 gNa2O2晶体中所含阴阳离子个数均为2NA
B.1.5 g CH3+中含有的电子数为NA
C.3.4 g氨中含有0.6NA个N-H键
D.常温下,100 mL1 mol·L-1AlCl3溶液中阳离子总数小于0.1NA
18.下列离子方程式正确的是 ( )
A.向Ba(OH)2溶液中滴加NH4HSO4溶液至刚好沉淀完全:
Ba2++2OH-+NH4++H++SO42-→BaSO4↓+NH3·H2O+ H2O
B.澄清石灰水与稀盐酸反应:Ca(OH)2+2H+→Ca2++2H2O
C.钠与水反应:2Na+2H2O→2Na++2OH-+H2↑
D.碳酸钡中加入稀硫酸:BaCO3+2H+→Ba2++CO2↑+H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com