
1、实验室制备下列物质的方法合理可行的是
A.苯与浓溴水在铁粉作用下,以制取溴苯
B.白醋和无水酒精及浓硫酸共热,以制取乙酸乙酯
C.将饱和NaCl溶液加入到电石中,以制备乙炔
D.无水乙醇与5 mol/L的硫酸共热至170℃,以制取乙烯
17.某学习小组利用下列装置探究氯气和氨气之间的反应,其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气和氨气的反应装置。
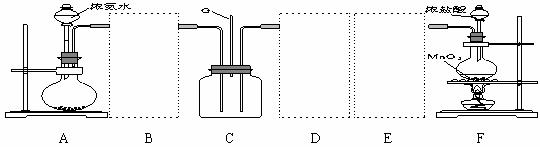
|
|
Ⅰ |
Ⅱ |
Ⅲ |
|
备选装置 |
 |
 |
 |
请回答下列问题:
(1)装置A中烧瓶内的固体可选用________________。
a. 烧碱 b. 生石灰 c. 二氧化硅 d. 五氧化二磷
(2)往装置A的烧瓶内加入粉末状固体的操作方法是:
______________________________________________________________________________。
(3)虚线框内应添加必要的除杂装置,请从上图的备选装置中选择并将编号填入下列空格。
B____________;D____________;E____________(填编号)。
(4)在实验过程中应如何合理控制装置A、F中分液漏斗上口的玻璃塞?
______________________________________________________________________________。
(5)装置C内出现白烟并在容器内壁凝结,鉴定该固体是氯化铵所需要的试剂和试纸有___________________________________________________________;所需的玻璃仪器除酒精灯外,还需要______________________________________________。
(6)有同学认为C中除有氯化铵生成外,还应有其他物质生成,你认为他的理由是_______________________________________;如果C中气体未出现红棕色,写出C中发生反应的化学方程式____________________________________________。
16.已知溴水中存在化学平衡:Br2+H2O HBr+HBrO,乙烯通入溴水中,生成A、B(B的化学式为C2H5BrO)和C2H5Br。
HBr+HBrO,乙烯通入溴水中,生成A、B(B的化学式为C2H5BrO)和C2H5Br。
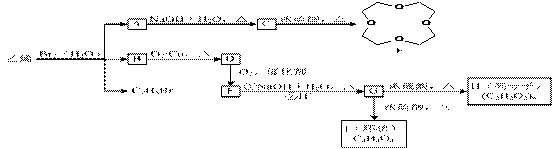
回答下列问题:
(1)E的分子式为_______________________。
(2)B的结构简式为_____________________,I的结构简式为_______________________。
(3)写出由G转化为H的化学方程式:__________________________________________,反应类型为______________________。
(4)A-I中,能发生银镜反应的物质的结构简式是_________________________________,B→D的反应类型为_______________________。
(5)指出C的两个重要用途__________________________,_________________________。
(6)乙烯是最重要的基础石油化工原料,工业上主要通过__________________来获得乙烯。
15.在一容积为2 L的密闭容器内加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g) 2NH3(g )+Q(Q>0)反应中NH3的物质的量浓度的变化的情况如下图:
2NH3(g )+Q(Q>0)反应中NH3的物质的量浓度的变化的情况如下图:
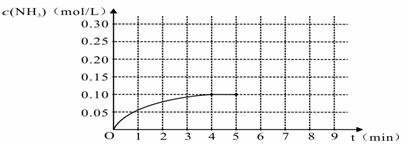
(1)根据上图,计算从反应开始到平衡时,平均反应速率v(NH3)为___________________。
(2)该反应的化学平衡常数表达式为_____________________________。
(3)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质
的量浓度不可能为_______________。
a.0.20 mol/L b.0.12 mol/L c.0.10 mol/L d.0.08 mol/L
(4)反应达到平衡后,第5分钟末,保持其它条件不变,若只把容器的体积缩小一半,平衡_________________________移动(填“向逆反应方向”、“向正反应方向”或“不”),化学平衡常数K________________(填“增大”、“减小”或“不变”)。
(5)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25 mol/L),请在上图中画出第5分钟末到此平衡时NH3浓度的变化曲线。
14.下列各组物质中,气体X和气体Y同时通入盛有溶液Z的洗气瓶中(如下图所示),在洗气瓶中一定不生成沉淀的是( )

|
|
X |
Y |
Z |
|
A |
NO2 |
SO2 |
BaCl2 |
|
B |
NH3 |
O2 |
Al2(SO4)3 |
|
C |
NH3 |
CO2 |
CaCl2 |
|
D |
CO2 |
HCl |
CaCl2 |
13. 将40℃的饱和澄清石灰水冷却至10℃或向其中加入少量CaO(但温度仍保持40℃),在这两种情况下均未改变的是( )
A.溶液的质量 B.溶液中溶质的物质的量浓度
C.溶液中Ca2+的数目 D.Ca(OH)2的溶解度
12. 25℃时,有p mol/L的醋酸,c(H+)=q mol/L,水的电离度为α1;n mol/L的NaOH溶液,水的电离度为α2 。两种溶液等体积混合后,所得溶液pH等于7,则下列关系中错误的是 ( )
A.反应后c(Na+)=c(CH3COO-)+c(CH3COOH)
B.α1<α2
C.p>n
D.q<n
11. 下列离子方程式正确的是( )
A.澄清石灰水与醋酸反应:CH3COOH+OH-→CH3COO-+H2O
B.碳酸氢铵溶液中加入过量氢氧化钠溶液:NH4++OH-→NH3↑+H2O
C.亚硫酸钠溶液中加入氯水:SO32-+Cl2+H2O→SO42-+2Cl-+2H+
D.向碳酸氢钠溶液中加入过量氢氧化钡溶液:
2HCO3-+Ca2++2OH-→CaCO3↓+2H2O+CO32-
10. 用启普发生器制取气体的优点是“随用随开,随关随停”。下列关于启普发生器的叙述正确的是( )
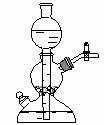
A.固体药品可从球型漏斗处加入
B.可用来制乙炔(用电石和水为原料)
C.可用来制H2S(用FeS和稀硫酸为原料)
D.上图是表示活塞关闭的状态
9.如下图所示,a、b是两根石墨棒。下列叙述正确的是( )
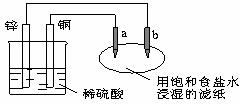
A.a是正极,发生还原反应
B.b是阳极,发生氧化反应
C.稀硫酸中硫酸根离子的物质的量不变
D.往滤纸上滴加酚酞试液,a极附近颜色变红
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com