
2.在一定条件下,当64gSO2气体被氧化成SO3气体时,放出热量98.3kJ。已知SO2在此条件下转化率为80%,则下列热化学方程式正确的是
A.SO2(g)+ O2(g)
O2(g) SO3(g) △H=-78.64kJ·mol-1
SO3(g) △H=-78.64kJ·mol-1
B.2SO2(g)+O2(g) 2SO3(l) △H=-196.6 kJ·mol-1
2SO3(l) △H=-196.6 kJ·mol-1
C.SO2(g)+ O2(g)
O2(g) SO3(g) △H=-98.3 kJ·mol-1
SO3(g) △H=-98.3 kJ·mol-1
D.2SO2(g)+O2(g) 2SO3(g) △H=+196.6 kJ·mol-1
2SO3(g) △H=+196.6 kJ·mol-1
1.2008奥运会吉样物福娃,其外材为纯羊毛线。内充物为无毒的聚酯纤维(结构简式如下图)。下列说法中,正确的是

A.羊毛与聚酯纤维的化学成分相同
B.聚酯纤维和羊毛在一定条件下均能水解
C.该聚酯纤维的单体为对苯二甲酸和乙醇
D.聚酯纤维和羊毛都属于天然高分子材料
29.( 13分)由丙烯经下列反应可得F、G两种高分子化合物,它们都是常用塑料的主要成分。

(1)聚合物F的结构简式是__________________ ,A→B的反应类型为
(2) D的结构简式是___________________________________________
(3) B转化为C的化学方程式是__________________________________________
(4) 在一定条件下,两分子E能脱去两分子水形成一种六元环化合物,该化合物的结构简式是_________________________________________
(5) E有多种同分异构体,其中一种能发生银镜反应,1mol该种同分异构体与足量的金属钠反应产生1mol H2,则该种同分异构体为_______________________________
28.(15分) A、B、C、D四种短周期元素,原子序数依次增大,离子半径依次减小,A与C可
形成原子个数比分别为l∶1和1∶2的两种离子化合物X、Y,A与D的原子序数之和等于B
与C的原子序数之和,请回答下列问题:
(1)X的电子式为: ,C的原子结构示意图为
A、B的气态氢化物更稳定的是 (填化学式)
(2)单质D在CO2中燃烧的化学方程式为
(3) 2 mol C的氢氧化物与2 mol B单质在一定条件下恰好完全反应,生成一种盐、水及一种气体,写出该反应的化学方程式
(4)常温下,B、C形成的化合物的水溶液中所有离子的物质的量浓度由大到小的顺为
27.( 19分)某研究性学习小组的同学用下图所示装置在实验室再现工业生产过程,加热装置已省略。
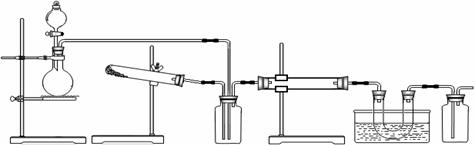
A B C D E F
(I)甲同学用此套装置研究二氧化硫催化氧化的过程,并制取少量三氧化硫晶体,D处盛放V2O5,E处为冰水浴。
(1)已知 6.4 g 二氧化硫被氧气氧化成气态三氧化硫,放出 9.83 kJ 热量。反应的热化学方程式为
(2)A中发生的化学反应方程式为
C装置中盛放的液体药品是
(3)D装置相当于硫酸工业生产中的 (填设备名称)
(4)在实验过程中D装置不能持续加热到太高温度的理由是
(II)乙同学认为此套装置可用于研究氨催化氧化的过程,D处盛放铂铑合金网,E处冰水冷却的U型管中有红棕色气体X生成且越接近U型管下部颜色越浅。A处没有加热装置。
(5)若A中产生的是氨气,则所用试剂为
(6)写出D装置中发生的化学反应方程式
(7)为什么此时U型管中的红棕色气体越接近管下部颜色越浅?
26.( 13分) 甲醇是重要的能源物质。合成甲醇的反应为: CO(g)+2H2(g) CH3OH(g);△H=Q
kJ·mol
CH3OH(g);△H=Q
kJ·mol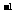 。一定条件下,在某密闭容器中进行上述反应。
。一定条件下,在某密闭容器中进行上述反应。
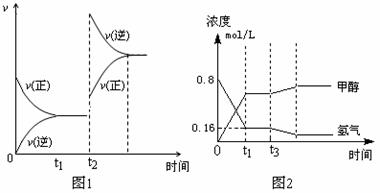
(1)下图1表示CO的反应速率与时间的关系曲线,则t2时改变的一个条件是_________________,上述反应的△H ____ (填>0、<0或无法判断)。
(2)若起始时充入2 mol CO和4 mol H2,下图2表示该反应在t1时达到平衡,在t3时改变某条件发生变化的曲线。试判断,图2中t3时改变的条件是___________,t1时CO的转化率为 。
(3)测定甲醇的质量分数时,常先用稀H2SO4酸化的重铬酸钾(K2Cr2O7)溶液氧化甲醇,甲醇被重铬酸钾氧化成CO2和H2O,Cr2O7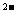 被还原为Cr3+,该反应的离子方程式为: ,每消耗4 mol
H+ 转移 mol 电子。
被还原为Cr3+,该反应的离子方程式为: ,每消耗4 mol
H+ 转移 mol 电子。
13.下列说法正确的是( )
A.CCl4是非极性分子,分子中C原子处在4个Cl原子所组成的正方形的中心
B.将SO2通入酸性高锰酸钾溶液中,溶液褪色,说明SO2具有漂白性
C.由C(石墨)= C(金刚石);△H =
+1.90 kJ·mol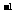 可知,金刚石比石墨稳定
可知,金刚石比石墨稳定
D.物质的量浓度相等的①NH4Cl ②(NH4)2SO4 ③NH4HSO4溶液,pH大小顺序为①>②>③
12.下列关于电化学的说法正确的是( )
A.原电池的负极和电解池阴极放电时都发生氧化反应
B.铅蓄电池放电时,每消耗0.1 mol Pb,共生成0.2 mol PbSO4
C.电解精炼铜时,电解池中阴极析出的铜和阳极上溶解的铜一样多
D.将金属a与直流电源的正极相连,而将负极接到废铁上,可防止金属a被腐蚀
11.下列实验设计能够成功的是( )
A.往2 mL硫酸铜溶液中滴加几滴NaOH稀溶液,振荡,以制备氢氧化铜浊液
B.往饱和的氯化铁溶液中加入适量的氢氧化钠,再加热至沸腾即可制备氢氧化铁胶体
C.分离苯和苯酚的混合液,先加入适量浓溴水,再过滤、分液,即可实现
D.用石墨作电极,电解Cu(NO3)2、AgNO3的混合溶液,来比较铜和银的还原性强弱
10.关于下列各实验和装置图的叙述中,不正确的是( )

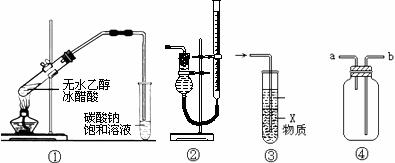
A.用图①所示的装置和试剂可制得乙酸乙酯
B.装置②可用于测定气体体积,读数前必须把左右两管液面调平
C.装置③中X若为四氯化碳,可用于吸收氨气,并能防止倒吸
D.装置④可用于收集H2、CO2、Cl2、HCl、NO2等气体(必要时可添加尾气处理装置)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com