
12.铜的冶炼大致可分为:⑴ 富集:将硫化物矿进行浮选;⑵ 焙烧,主要反应为:
2CuFeS2+4O2=Cu2S+3SO2+2FeO(炉渣);⑶ 制粗铜,在1200℃发生的主要反应:
2Cu2S+3O2=2Cu2O+2SO2;2Cu2O+Cu2S=6Cu+SO2↑⑷ 电解精炼。
下列说法正确的是
A.上述灼烧过程的尾气均可直接排入空气
B.由6mol CuFeS2生成6molCu,反应共消耗15molO2
C.电解精炼时,粗铜应与外电源正极相连
D.反应2Cu2O+ Cu2S=6 Cu+SO2↑中,氧化剂只有Cu2O
11.在25℃时,将两个铜电极插入一定质量的硫酸钠饱和溶液中进行电解,通电一段时间后,阴极上析出a mol气体,同时有W g Na2SO4•10H2O晶体析出。则原饱和溶液中溶质的质量分数为
A. B.
B. C.
C. D.
D.
10.某弱酸的酸式盐有NaH2XO4和Na2HXO4,其中NaH2XO4的溶液呈酸性,Na2HXO4溶液呈碱性。常温下,浓度均为0.1mol•L-1NaH2XO4溶液和Na2HXO4溶液中均存在的关系是
A.c(H+)•c(OH-)=1×10-14
B.c(H+)+2c(H3XO4)+c(H2XO4-)=c(XO43-)+c(OH-)
C.c(H+)+c(H3XO4)=c(HXO42-)+2c(XO43-)+c(OH-)
D.c(Na+)+c(H+)=c(H2XO4-)+c(OH-)+2c(HXO42-)+3c(XO43-)
9.U常见化合价有+4和+6,硝酸铀酰[UO2(NO3)2]加热可发生如下分解(未配平):
UO2(NO3)2―UxOy+NO2↑+O2↑600K时,将气体产物集于试管并倒扣水中,水充满试管。则生成铀的氧化物化学式是
A.UO2 B.UO3 C.2UO2·UO3 D.UO2·2UO3
8.某锂离子电池的正极材料是锂过渡金属氧化物(例如LiCoO2)混以一定量的导电添加物(例如C)构成的混合导体,负极材料是可插入锂的碳负极。放电时电极反应式:
负极:LixC6→ C6+xLi++xe- 正极:Li0.5CoO2+0.5Li++0.5e-→LiCoO2充、放电时电池中的变化简单表示为:LiCoO2 xLi++xe-
xLi++xe- LixC6,其中表示充电过程的是
LixC6,其中表示充电过程的是
A.b-阳极变化、c-阴极变化 B.b-阳极变化、d-阴极变化
C.a-阳极变化、c-阴极变化 D.a-阳极变化、d-阴极变化
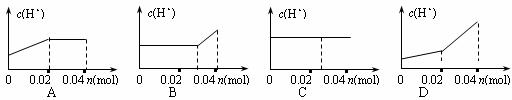
7.已知Br2+H2SO3+H2O=2HBr+H2SO4。将0.04mol Cl2缓缓通入含0.02mol H2SO3和 0.02mol HBr的混合溶液中,在此过程中,溶液的c(H+)与Cl2用量(物质的量 n)的关系示意图是(溶液的体积视为不变)
6.表示下列各反应的离子方程式中,不正确的是
A.铁屑溶于足量稀硝酸:Fe+4H++NO3-=Fe3++NO↑+2H2O
B.水玻璃(硅酸钠水溶液)中滴加稀盐酸:Na2SiΟ3+2H+=2Na++H2SiO3↓
C.将0.5mol Cl2通入含1mol FeBr2的溶液中:Cl2+2Fe2+=2Fe3++2Cl-
D.苯酚钠溶液中通入少量CO2:C6H5O-+CO2+H2O→C6H5OH+HCO3-
5.某无色溶液能与NH4HCO3作用产生气体,此溶液中一定能大量共存的离子组是
A.K+、NO3-、Cl-、Ca2+ B.ClO-、K+、I-、Cl-
C.Cl-、Na+、Cu2+、SO42- D.Na+、Mg2+、SO42-、Cl-
4.设NA代表阿伏加德罗常数,下列说法正确的是
A.电解精炼铜过程中,电路中每转移0.2NA电子,阳极溶解铜6.4g
B.用石墨作电极电解Ca(NO3)2溶液,当转移电子0.2NA时,阴极析出4g金属
C.常温下含有NA个NO2、N2O4分子的混合气,降温至标准状况时体积约22.4L
D.0.1mol 24Mg32S晶体中所含中子总数为2.8NA
3.赤铜矿的主要成分是Cu2O,辉铜矿的主要成分是Cu2S,将赤铜矿与辉铜矿混合加热有以下反应:Cu2S+2Cu2O 6Cu+SO2↑,下列关于该反应的说法中,正确的是
6Cu+SO2↑,下列关于该反应的说法中,正确的是
A.Cu2S在反应中既是氧化剂,又是还原剂
B.每生成19.2g Cu,反应中转移0.6mol电子
C.该反应的氧化剂只有Cu2O
D.Cu既是氧化产物又是还原产物
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com