
21.(8分)在体积为2 L的密闭容器中,充入lmol CO2和2.6mol H2,一定条件下发生反应:
CO2(g)+3H2(g)  CH3OH(g)+H2O(g)△H= -49.0 kJ·mol-1
CH3OH(g)+H2O(g)△H= -49.0 kJ·mol-1
测得CO2和CH3OH(g)的浓度随时间变化如下图所示:

(1)从反应开始到第10 min,氢气的平均反应速率v(H2)= ,在这段时间内,反应放出的热量= 。
(2)在该条件下,反应的平衡常数K的值 = ,如果在某一时刻保持温度不变,只改变浓度,使c(CO2) =1.00 mol/L,c(H2) = 2.00 mol/L,c(CH3OH) = c(H2O) = 0.80 mol/L,则平衡 (填写序号)。
a.向正反应方向移动 b.向逆反应方向移动 c.不移动 d.无法确定平衡移动方向
(3)下列措施中能使n(CH3OH)/n(CO2)增大的是 (填写序号)。
a.升高温度 b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离 d.再充入l mol CH3OH(g)
(4)在催化剂的作用下,CO2与H2能够合成许多物质,如甲醇、烃类、二甲醚等,但反应体系中若混入杂质,则反应很难进行,可能的原因是 。
20.(8分)已知X是一种盐,H是第三周期某金属元素的单质,F、I是常见非金属单质,D常用作呼吸面具的供氧剂,E、G都是工业上重要的碱性物质,它们有下图所示的关系。

试回答下列问题:
(1)B的电子式为: ;
G的化学式为:_______________。
(2)写出下列反应的化学方程式
①_____________________________;
②_____________________________。
(3)X在医药上用作解酸剂,与盐酸作用时,生成B的物质的量与消耗盐酸的物质的量之比为3∶8,则X的化学式为:________________。
19.(9分)在化学分析中,常需用KMnO4标准溶液,由于KMnO4晶体在室温下不太稳定,因而很难直接配制准确物质的量浓度的KMnO4溶液。实验室一般先称取一定质量的KMnO4晶体,粗配成大致浓度的KMnO4溶液,再用性质稳定、相对分子质量较大的基准物质草酸钠[Mr(Na2C2O4)=134.0]对粗配的KMnO4溶液进行标定,测出所配制的KMnO4溶液的准确浓度,反应原理为:C2O42-+MnO4-+H+→CO2↑+Mn2++H2O
以下是标定KMnO4溶液的实验步骤:
步骤一:先粗配浓度约为0.15mol·L-1的高锰酸钾溶液500 mL。
步骤二:准确称取Na2C2O4固体m g放入锥形瓶中,用蒸馏水溶解并加稀硫酸酸化,加热至70~80℃,用步骤一所配高锰酸钾溶液进行滴定。记录相关数据。
步骤三: 。
步骤四:计算,得高锰酸钾的物质的量浓度。试回答下列问题:
(1)配平反应方程式: C2O42-+ MnO4-+ H+→ CO2↑+ Mn2++ H2O
(2)该滴定实验 (“需要”或“不需要”)加指示剂。
(3)步骤二中滴定操作图示正确的是__________(填编号)。
(4)步骤二的滴定过程温度变化并不明显,但操作过程中发现前一阶段溶液褪色较慢,中间阶段褪色明显变快,最后阶段褪色又变慢。试根据影响化学反应速率的条件分析,溶液褪色明显变快的原因可能是_________ ,最后又变慢的原因是 。
(5)请写出步骤三的操作内容 。
(6)若m的平均数值为1.340g,滴定的KMnO4溶液平均用量为25.00mL,则KMnO4溶液的浓度为 mol·L-1。
18.(9分)海水中含有丰富的化学元素,下面是某化工厂从海水中提取NaCl、Mg(以MgCl2形式存在)和Br2(以NaBr的形式存在)及综合利用的生产流程简图:
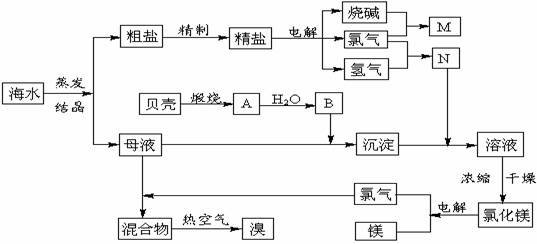
请回答:
(1)在粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用的试剂为
A.盐酸 B.氯化钡溶液 C.氢氧化钠溶液 D.碳酸钠溶液。
则加入试剂的顺序是(填编号) 。
(2)目前工业上主要采用离子交换膜法电解饱和食盐水,下列关于离子交换膜电解槽的叙述错误的是 。
A.精制饱和食盐水进入阳极室 B.纯水(加少量NaOH)进入阴极室
C.阴极产物为氢氧化钠和氢气 D.电解槽的阳极用金属铁网制成
(3)写出电解饱和NaCl溶液的离子反应方程式: 。
(4)此工业煅烧贝壳得到氧化钙。石灰石和贝壳的主要成份相同,事实上,石灰石在许多化学工业生产都发挥了极大的作用,请写出一条化工生产中碳酸钙参与的化学反应方程式(此工业涉及的方程式除外) 。
(5)利用MgCl2· 6H2O可制得无水氯化镁,应采取的措施是 。
(6)用热空气吹出的溴蒸气可以用亚硫酸钠溶液吸收,写出反应的化学方程式:
。
17.(9分) A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素原子的电子层数为n,最外层电子数为2n+l,A、B、C、E每种元素都能与D元素组成两种或两种以上的常见化合物。回答下列问题:
(1)写出下列各元素的名称:C___________ E____________
(2)已知:BA3DA(g)+A2D(g)=BD2(g)+3A2(g) △H= +49.0kJ/mol
BA3DA(g)+1/2D2(g)=BD2(g)+2A2(g) △H = 一192.9kJ/mol
试写出:气态BA3DA完全燃烧生成气态A2D的热化学方程式(用推出的元素符号写)
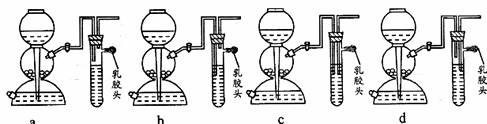
(3)点燃不纯的A2气体可能会发生爆炸,为了防止意外,可连接一个安全装置。下图的装置能起到此作用的是___________。
(4)由A、B、C、D四种元素可以组成多种既能与强酸反应又能与强碱反应的化合物。其中有一种在加热条件下能分解生成等物质的量的三种产物,该化合物是 ;另一种是人体必须的营养物质,它的相对分子质量为75,该化合物是 。
16.常温下,下列各溶液中微粒的物质的量浓度关系正确的是
A.0.1 mol·L-1的Na2CO3溶液中:c(Na+)= c(CO32-)+c(HCO3-)+ c(H2CO3)
B.0.1mol·L-1的NH4Cl溶液与0.1mol·L-1的NaOH溶液等体积混合后,得到pH>7的溶液中:
c(Cl-)=c(Na+)>c(NH4+)>c(OH-)>c(H+)
C.浓度分别为0.1 mol·L-1和0.01 mol·L-1的CH3COOH溶液中:CH3COO-离子浓度前者大于后者的10倍
D.pH=11的Na2CO3溶液中:c(Na+) - 2c(CO32-) - c(HCO3-) = 10-3 - 10-11
第II卷(共52分)
15.LiFePO4新型锂离子动力电池以其独特的优势成为奥运会绿色能源的新宠.已知该电池放电时的电极反应式为:正极 FePO4+Li++e-==LiFePO4 ,负极 Li-e-== Li+ 。下列说法中正确的是
A.充电时电池反应为FePO4+Li = LiFePO4
B.充电时动力电池上标注“+”的电极应与外接电源的正极相连
C.放电时电池内部Li+向负极移动
D.放电时,在正极上是Li+得电子被还原
14.下表是五种银盐的溶度积常数Ksp(25℃)
|
化学式 |
AgCl |
Ag2SO4 |
Ag2S |
AgBr |
AgI |
|
溶度积 |
1.4×10-10 |
1.4×10-5 |
6.3×10-50 |
7.7×10-13 |
8.51×10-16 |
下列说法不正确的是
A.五种物质在25℃时溶解度(mol·L-1)最大的是Ag2SO4
B.在氯化银的悬浊液中加入Na2S溶液则可以生成黑色的Ag2S
C.25℃时,AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶度积和溶解度都相同
D.沉淀溶解平衡的建立是有条件的,外界条件改变时,平衡也会发生移动
13.已知某可逆反应aA(g) + bB(g)  cC(g) + dD(g)。反应过程中,当其它条件不变时,C的体积分数与温度(T)和压强(P)的关系如下图。下列叙述正确的
cC(g) + dD(g)。反应过程中,当其它条件不变时,C的体积分数与温度(T)和压强(P)的关系如下图。下列叙述正确的
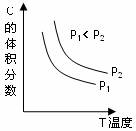
A.正反应为吸热反应 B.降低温度,正反应速率增大
C.a + b < c + d D.增大压强,逆反应速率增大
12.已知维生素A的结构简式如下图,关于它的说法正确的是

A.维生素A分子含有氢原子数为奇数
B.维生素A的分子中含有苯环结构
C.1mol维生素A在催化剂作用下,可以和3molH2完全加成
D.维生素A属于醇,是一种脂溶性维生素
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com