
3.二十世纪化学合成技术的发展对人类健康水平和生活质量的提高做出了巨大贡献。下列各组物质全部由化学方法合成得到的是 ( )
A.玻璃 纤维素 青霉素 B.尿素 食盐 聚乙烯
C.涤沦 洗衣粉 阿斯匹林 D.石英 橡胶 磷化铟
2.下列现象或应用不能用胶体知识解释的是 ( )
A.肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗
B.牛油与NaOH溶液共煮,向反应后所得的溶液中加入食盐析出固体
C.氯化铝溶液中加入小苏打溶液会产生白色沉淀和气体
D.水泥冶金厂常用高压电除去工厂烟尘,减少对空气污染
1.下列家庭小实验中不涉及化学变化的是 ( )
A.用熟苹果催熟青香蕉
B.用少量食醋除去水壶中的水垢
C.用糯米、酒曲和水制成甜酒酿
D.用鸡蛋壳膜和蒸馏水除去淀粉胶体中的食盐
22.(6分)将Cu与CuO的混合物10.4g加入到50mL,18.0mol/L浓H2SO4中,加热充分反应至固体物质完全溶解,冷却后将混合液稀释至1000 mL,测得c(Cu2+)=0.15 mol/L。试计算(不考虑气体在溶液中的溶解):
(1)反应过程中被还原的H2SO4的物质的量。
(2)溶液稀释后, c(H+)是多少?
21.(4分)将装有30mL NO和NO2混合气体的试管倒立于水中,经过足够时间,到水面不再上升为止,此时试管内剩余气体的体积为16mL。求原混合气体中NO和NO2的体积各是多少毫升?
20.(11分)某兴趣小组同学共同设置了如图所示的实验装置。即可用于制取气体,又可用于验证物质的性质。请回答下列问题:

(1)利用装置I制取气体,生成气体的反应应具备的条件是_______________________。
(2)利用I、Ⅱ装置制取气体(K2关闭,K1打开)。甲同学认为利用II装置可以收集NH3,但不能收集NO,其理由是_______________________,乙同学认为将II装置作简易改进(不改变仪器位置)也可以收集NO,改进的方法是_______________________。
(3)利用I、Ⅲ装置验证物质的性质(K2打开,K1关闭)。
①若A中为30%H2O2溶液,B中加入MnO2,C中盛氢硫酸H2S的水溶液,旋开K3后,C中出现浅黄色浑浊现缘,C中反应的化学方程式为_______________________。
②若A中为浓氨水,B中加入生石灰,C中盛FeCl3溶液,旋开K3后,C中的现象是_______________________, C中反应的离子方程式为_______________________,仪器D在此实验中的作用是_______________________。
③若A中为浓盐酸,B中加入KMnO4,C中盛淀粉KI溶液,旋开K3,B中观察到的明显现象是_______________________, C中的现象是_______________________,由此实验可得出的结论是_______________________。
19.(9分)已知A、B、C、D、E、F、G、H可以发生如下图所示的转化,反应中部分生成物已略去。其中A、G为同一主族元素的单质,B、C、H在通常情况下为气体,化合物C是一种形成酸雨的大气污染物。请回答下列问题:
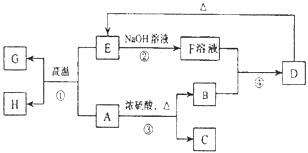
(1)C物质的化学式_______________________
(2)反应①的化学方程式为_______________________。
(3)反应④的离子方程式为_______________________。
(4)用下图所示装置验证反应③产物的气体中含有B和C:_______________________

确认混合气体中含C的试剂瓶及现象是 _______________________。
确认混合气体中含B的试剂瓶及现象是_______________________。
18.(11分)由几种离子化合物组成的混合物,含有以下离子中的若干种:Cl-、CO2-3、SO42-、Na+、NH4+、Ca 2+。将该混合物溶于水后得澄清溶液,现取3份100 mL该溶液分别进行如下实验:
|
实验序号 |
实 验 内
容 |
实 验 结
果 |
|
① |
加AgNO3 |
有白色沉淀生成 |
|
② |
加足量NaOH溶液并加热 |
收集到气体672mL(已这算成标准状况) |
|
③ |
加足量BaCl2溶液时,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后洗涤、干燥、称量 |
第一次称量读数为4.30g,第二次称量读数为2.33g |
试回答下列问题:
(1)根据实验①对Cl-是否存在的判断是_______________________(填“一定存在”、“一定不存在”或“不能确定”),理由是_______________________。
(2)根据实验①-③判断混合物中一定不存在的离子是_______________________。
(3)实验②中反应的离子方程式为_______________________。
(4)溶液中一定存在的阴离子及其物质的量浓度(可不填满):
|
阴离子符号 |
物质的量浓度(mol·L-1) |
|
|
|
|
|
|
|
|
|
(5)溶液中Na+是否存在? _____________________,判断的理由是____________________
17.(11分)下表是元素周期表的一部分,表中所列的字母分别代表某一化学元素。用元素符号或化学式回答下列问题:
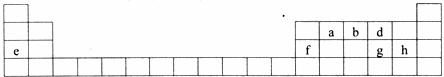
(1)这些元素中,金属性最强的是_______________________。
(2)a、b、d、g元素的氢化物中,最稳定的是_______________________ 。
(3)f、a、d三种元素原子半径由大到小的顺序排列为_______________________ 。
(4)a与d形成的化合物X是非极性分子,X的电子式是_______________________。
(5)h、Y两元素原子次外电子层上的电子数相等,h与Y形成的化合物在水溶液中能电离出电子层结构相同的离子,则Y元素的符号可能是_______________________。
(6)b、h两元素形成的化合物分子中各原子最外层都达到8电子稳定结构,该物质遇水剧烈反应,生成两种产物,其中之一的分子构型为三角锥形,另一种物质具有漂白性,其反应的化学方程式为_______________________。
21.(10分)常温下,在27.5g水中溶解12.5g CuSO4·5H2O,恰好达到饱和,该溶液密度为1.21g /cm3,求:
① 该溶液中阴阳离子的总物质的量
② 该溶液中CuSO4的物质的量浓度
③ 取出20.0 ml该溶液,配成浓度为1.00 mol/L的稀溶液,则稀释后溶液的积是多少毫升?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com