
2.下列说法不正确的是
A.分子为C3H8与C6H14的两种有机物一定互为同系物
B.具有相同通式的有机物不一定互为同系物
C.两个相邻同系物的相对分子质量数值一定相差14
D.分子组成相差一个或几个CH2原子团的化合物必定互为同系物
1.目前造成城市空气中铅污染的主要来源是
A.煤的燃烧 B.汽车废气 C.垃圾燃烧 D.废塑料燃烧
27.(12分)
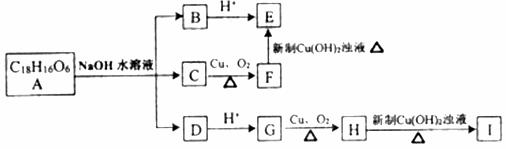
图为A-Ⅰ几种有机物间的转化关系,其中B、C、D三种物质的物质的量之比为1:1:2,F是其同系物中相对分子质量最小的物质,它的水溶液常用作浸泡生物标本和手术器材消毒,Ⅰ的苯环上一氯代物只有一种。
请回答下列问题:
(1)写出A的结构简式 。
(2)写出化学方程式并指出反应类型
①F→E ,所属反应类型是 。
(3)I与C在浓硫酸作用下按物质的量比1:1反应 ,所属反应类型是 。
(4)G的同分异构体有多种,写出符合下列条件的G得同分异构体:
①能发生水解反应 ②苯环上的一氯代物只有两种
③遇FeCl3溶液显色
。
26.(10分)某课外活动小组,利用实验测定Cu元素的相对原子质量,共设计了两种方案:
方案一:向未知浓度的硫酸铜溶液中加入m1g铁粉,反应一会过滤,洗涤、干燥、称重,质量变为m2g,再置于足量稀盐酸中,充分反映,过滤,洗涤,干燥后称重为m3g。
则这种方案所测得的铜的相对原子质量的表达式为 。
方案二:用CO还原氧化铜的方法

步骤:
①如图连接好装置,并检验装置的气密性。
②先通一段时间的CO气体。
③实验加热一段时间后停止加热,再通一段时间的CO气体。
④将A中残留物取出依次用稀盐酸和蒸馏水充分洗涤、干燥、称重,得固体质量为m1g。
⑤测得C装置增重m2g。
请回答下列问题:
(1)铜元素的相对原子质量的表达式为 。
(2)步骤③为什么还要通一段时间的CO气体? 。
(3)实验方案二的不妥之处是 。
25.(11分)
(1)配平氧化还原反应方程式,在方框内填写化学计量数。

(2)欲配制物质的量浓度为0.1 mol/L的高锰酸钾溶液450mL,所需玻璃仪器有: ,所需KMnO4晶体的质量为 g。
(3)今有含K2SO4杂质K2C2O4晶体,某实验小组欲测定该样品纯度,取样品10g配成200.0mL溶液,取出20.0mL用硫酸酸化,再用上述高锰酸钾溶液进行滴定,当达到滴定终点时消耗KMnO4溶液的体积为24.0mL,则此样品的纯度为 ,滴定终点时颜色变化为 。
24.(11分)
A、B、C、、D、E为五种短周期元素,原子序数依次增大,且原子序数间存在以下关系:
A+B=C,A+C=D。A、B、C、D是构成火棉和炸药TNT的四种元素,D和E形成的简单离子电子层结构相同,A和E同族。
请回答以下问题:
(1)写出元素符号:
B ,C ,D ,E 。
(2)化合物M中,A、B、D、E四种元素的原子个数之比为1:1:2:1,则化合物M的名称为 ,其水溶液中,各离子浓度的大小关系是 。
(3)某化合物由A、D、E三种元素组成,写出工业上生产这种化合物的离子方程式:
(4)D和E的单质在加热条件下反应的化学方程式为 ,生成物的电子式为 。
23.(7分)
在密闭容器中投入一定量的A和B发生反应:mA(g)+nB(g)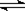 pC(g)。
pC(g)。
(1)欲使A与B的转化率等于m:n,则起始加入A、B的物质的量之比是 。
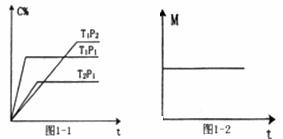
(2)充入一定量的A、B,若在不同条件下C的体积分数随时间的变化如图1-1所示,则m+n与p的关系式m+n p(填“>”、“<”或“=”),T1(填“>”、“<”或“=”)
T2,该反应的正反应的△H(填“>”、“<”或“=”) 0,
(3)一定条件下,从正反开始达到化学平衡过程中,混合气体的平均相对分子质量随时间的变化如图1-2所示。若在恒温恒容的条件下,向原平衡体系中再通入一定量的C,则体系中气体的平均相对分子质量(填“增大”、“减小”、“不变”或“无法确定”) 。
22.(8分)
用铜电极电解氢氧化钠溶液,通电一段时间后,你观察到的现象是 。
电极反应方程式为:阳极: ,阴极: 。
21.(4分)
下列有关化学实验操作正确的有 。
①实验室用盛装饱和碳酸钠溶液的试管收集乙酸乙酯
②为证明淀粉水解反应,取少量反应混合物,先加NaOH溶液中和硫酸,再加入新制氢氧化铜悬浊液并加热,有红色沉淀生成。
③验证RX时碘化烷,把RX与烧碱水溶液混合加热后,将溶液冷却后再加入硝酸银溶液。
④实验室用无水乙醇和浓硫酸供热制乙烯时,把温度计水银球插入液面以下。
⑤向皂化反应后的溶液里加入食盐,静置后进行分液操作以得到肥皂。
20.已知H2(g)+I2(g)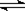 2HI(g);△H<0。有相同容积的定容密闭容器甲和乙,甲中加入H2和I2各0.1 mol,乙种加入HI 0.2 mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是 ( )
2HI(g);△H<0。有相同容积的定容密闭容器甲和乙,甲中加入H2和I2各0.1 mol,乙种加入HI 0.2 mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是 ( )
A.甲升高温度,乙不变 B.甲中加入0.1 mol He,乙不变
C.甲、乙提高相同温度 D.甲增加0.1 mol H2,乙不变
第Ⅱ卷(非选择题,共62分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com