
6.如果a g 某气体中含有分子数为b,则c g该气体在标准状况下的体积是 ( )
A. B.
B. C.
C.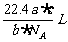 D.
D.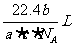
5.下列有关气体体积的叙述中,正确的是 ( )
A.在一定的温度和压强下,各种气态物质体积大小由构成气体分子大小决定
B.在一定的温度和压强下,各种气态物质体积的大小由构成气体的分子数决定
C.不同的气体,若体积不同,则它们所含的分子数一定不同
D.气体摩尔体积是指1 mol任何气体所占的体积约为22.4L
4.下列有关叙述正确的是 ( )
①碱金属单质的密度通常情况下均比水小
②碱金属元素均具有强还原性
③碱金属的氢氧化物在加热的条件下均不分解
④热稳定性:Na2CO3>NaHCO3>H2CO3
⑤CsOH是离子化合物,易溶于水,且碱性比NaOH强
⑥Cs2CO3加热易分解成Cs2O和CO2
⑦Na、K、Rb、Cs中,Cs的熔点最高,密度最大
A.全部 B.全不正确 C.④⑤ D.①②④⑤⑦
3.下列离子方程式书写正确的是 ( )
A.向碳酸氢钠溶液中滴入氢氧化钠 HCO3-+OH-=CO32-+H2O
B.向碳酸氢钾溶液中滴入过量澄清石灰水 HCO3-+Ca2++OH-=CO32-+H2O+CaCO3↓
C.次氯酸钠溶液中通入过量的二氧化硫 ClO-+SO2+H2O=HSO3-+HClO
D.硫酸铜和氢氧化钡溶液混合 Cu2++SO42-+Ba2++2OH-=Cu(OH)2↓+BaSO4↓
2.下列反应中,Na2O2既不是氧化剂又不是还原剂的是 ( )
A.2Na2O2+2H2O=4NaOH+O2↑ B.2Na2O2+2CO2=2Na2CO3+O2↑
C.2Na2O2+H2SO4=Na2SO4+H2O2 D.3Na2O2(熔融)+Fe2O3=2Na2FeO4+Na2O
1.在pH=1的某无色溶液中能大量共存的离子组是 ( )
A.NH4+、Mg2+、SO42-、Cl- B.Ba2+、K+、OH-、NO3-
C.Al3+、Cu2+ 、SO42-、Cl- D.Na+、Ca2+、AlO2- 、Cl-
27.在离子晶体中、阴、阳离子按一定规律在空间排列,下图(a)是NaCl的晶体结构,在离子晶体中,阴、阳离子具有或近似具有球形对称结构,它们可以被看作是不等径的刚性圆球,并彼此相切,例如NaCl晶体结构如图(b),已知a为常数。

已知气体在某温度压强下与体积之间的关系可以用公式:

计算,其中R为常数,数值为0.082。
(1)在NaCl晶体中,每个Na+ 同时吸引 个Clˉ;Na+ 数目和Clˉ数目之比为
;(2)Na+ 半径与Clˉ半径之比
(已知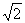 =1.414);
=1.414);
(3)NaCl晶体中不存在分子,但在1.013×105Pa,1413℃时,NaCl晶体形成气体,并以分子形式存在。现有29.25克NaCl晶体,在1.013×105Pa时强热使温度达到1501.5℃,测得气体体积为36.4L,试应用有关物理、化学知识计算此时氯化钠气体的分子式(不写计算过程);
(4)若a=5.6×10-8cm,求NaCl晶体的密度(已知5.6 3=175.6,NaCl的摩尔质量为58.5g/mol)。
26.(8分)50ml 0.50mol·L-1盐酸和50ml 0.55mol·L-1烧碱在如下图所示的装置中进行中和反应,通过测定反应中所放出的热量可计算中和热;回答下列问题:
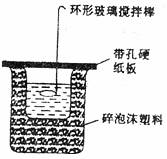
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是
(2)烧杯间填满碎泡沫塑料的作用是
(3)大烧杯如不盖硬纸板,求得中和热的数值将 (填偏大、偏小或无影响)
(4)实验中改用60ml 0.50mol、L-1的盐酸跟50ml 0.50mol、L-1的烧碱溶液进行上述反应,与上述实验相比,所放出的热量 (填“相等”或“不等”)所求的中和热 (填“相等”或“不等”)简述理由
(5)若三次平行操作测得数据起始时盐酸与烧碱平均温度相同而终止温度与起始温度差(t2– t1)分别为①2.3℃②2.4℃③2.9℃,则最终代入计算式温度差平均为 ℃。
25.(9分)在测定硫酸铜晶体中结晶水的含量的实验操作中:
(1)加热前晶体应该放在 中研碎,加热时是放在 中进行,加热失水后,应在 中冷却。
(2)判断是否完全失水的方法是 。
(3)做此实验时,最少应该进行称量操作 次。
(4)下面是某学生一次实验的数据,请完成计算,填入下面的表中。
|
坩埚质量 |
坩埚与晶体的总质量 |
加热后坩埚与固体的总质量 |
测得晶体中结晶水个数 |
|
11.7g |
22.7g |
18.6g |
|
(5)这次实验中产生误差的原因可能是 (填选项)
A.硫酸铜晶体中含有不挥发的杂质 B.实验前晶体表面有水
C.加热时有晶体飞溅出去 D.加热失水后露置在空气中冷却
24.(11分)信息I:通常人们拆开1mol某化学键所吸收的能量看成该化学键的键能,键能大小可以平衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
信息II;SiX4为分子式。
|
化学键 |
Si-O |
Si-F |
H-H |
H-Cl |
Si-Si |
Si-C |
Si-Cl |
|
键能 /kJ·mol |
460 |
525 |
436 |
431 |
176 |
347 |
360 |
请完成下列问题:
(1)比较下列两组物质的熔点高低(填“>”或“<”)
SiC Si; SiF4 SiO2 SiF4 SiCl4
(2)下图立体中心的“●”表示硅晶体中的一个原子,请在立方体的顶点用“●”表示出与之紧邻的硅原子。

(3)工业上的高纯硅可通过下列反应制取:
SiCl4(g)+2H2(g) Si(S)+4HCl(g)
Si(S)+4HCl(g)
该反应的反应热:△H= kJ/mol
(4)理论推测第二主族元素的氯化物如果几何形状相同时熔点由高到低的顺序为
BeCl2>MgCl2>CaCl2>SeCl2>BaCl2,原因是 ,实际测定的结果BeCl2的熔点最低,其它氯化物熔点高低顺序不变理由是
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com