
16.在隔绝空气的条件下,某同学将一块部分被氧化的钠块用一张已除去氧化膜、并用针刺一些小孔的铝箔包好,然后放入盛满水且倒置于水槽中的容器内。待钠块反应完全后,在容器中仅收集到1.12 L氢气(标准状况),此时测得铝箔质量比反应前减少了0.27 g,水槽和容器内溶液的总体积为2.0 L,溶液中NaOH的浓度为0.050 mol·L-1(忽略溶液中离子的水解和溶解的氢气的量)。
(1)写出该实验中发生反应的化学方程式。(3分)
(2)试通过计算确定该钠块中钠元素的质量分数。(7分)
15.某学生利用氯酸钾分解制氧气的反应,测定氧气的摩尔质量。实验步骤如下:
①装好实验装置。
②检查装置气密性。
③把适量的氯酸钾粉末和少量二氧化锰粉末混合均匀,放入干燥的试管中,准确称量,质量为ag。
④加热,开始反应,直到产生一定量的气体。
⑤停止加热(如下图,导管出口高于液面)。

⑥测量收集到气体的体积。
⑦准确称量试管和残留物的质量为bg。
⑧测量实验室的温度。
⑨把残留物倒入指定的容器中,洗净仪器,放回原处,把实验桌面收拾干净。
⑩处理实验数据,求出氧气的摩尔质量。
回答下列问题:
(1)如何检查装置的气密性?
(2)以下是测量收集到气体体积必须包括的几个步骤;①调整量筒内外液面高度使之相同;②使试管和量筒内的气体都冷却至室温;③读取量筒内气体的体积。这三步操作的正确顺序是: (请填写步骤代号)。
(3)测量收集到气体体积时,如何使量筒内外液面的高度相同? 。
(4)如果实验中得到的氧气体积是c L(已换算成标准状况下),水蒸气的影响忽略不计,氧气的摩尔质量的计算式为(含a、b、c,不必化简):M(O2)= 。
14.已知氨气跟氯气可迅速反应生成氯化铵和氮气。当转移的电子总数为a个时,生成的氮气的物质的量bmol.
(1)写出该反应配平的化学方程式:
(2)该反应中参加氧化还原反应的氧化剂和还原剂的物质的量之比为 。
(3)阿伏加德罗数常数为(用含a、b的代数式表示) 。
13.取等物质量浓度的NaOH溶液两份,每份为50ml。向其中通入一定量的CO2,随后分别取溶液10ml,将其稀释成100ml,并分别向稀释后的溶液中逐滴加入0.1mol/L的HCl溶液,产CO2的体积(标准状况)与加入盐酸体积之间的关系如图所示(设分别为A、B两种情况)。

回答下列问题:
(1)在(A)情况下,溶质为(写化学式) ,其物质的量之比为 ,在标准状况下,通入CO2气体的体积为 。
(2)在(B)情况下,溶质为(写化学式) ,其物质的量之比为 ,在标准状况下,通入CO2气体的体积为 。
(3)原NaOH溶液的物质的量浓度为 。
12.设NA代表阿伏加德罗常数的值,下列说法正确的是 ( )
A.1.8g铵根离子所含的电子数为1.1NA
B.1mol白磷分子中所含共价键数为4NA
C.标准状况下22.4L乙醇所含的分子数必定为NA
D.在电解食盐水的实验中,测得电解后溶液pH为14,又知电解后溶液总体积为1L,则阴极析出的气体的分子数为0.5NA
11.下列各组中两种气体的分子数一定相等的是 ( )
A.温度相同、体积相同的O2和N2
B.质量相等、密度不等的N2和C2H4
C.体积相同、密度不相等的CO和C2H4
D.压强相同,体积相同的O2和H2
10.在两个容积相同的容器中,一个盛有HCl气体,另一个盛有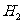 和
和 的混合气体。在同温同压下,两容器内的气体一定具有相同的 ( )
的混合气体。在同温同压下,两容器内的气体一定具有相同的 ( )
A.原子数 B.密度 C.质量 D.质子数
9.某学生用量筒量取液体、量筒放平稳且面向刻度线、初次仰视液面读数为19mL倾出部分液体后,俯视液面,读数是11mL则实际倾出液体的体积是 ( )
A.8ml B.大于8mL C.小于8mL D.无法判断
8.关于容量瓶的四种叙述:①是配制准确浓度的仪器;②不宜贮藏溶液;③不能用来加热;④使用之前要检查是否漏水。这些叙述中正确的是 ( )
A.①②③④ B.②③ C.①②④ D.②③④
7.用蒸汽密度法测定物质的相对分子质量是一种常用的方法。现测得0.2g某挥发性液体化合物样品在挥发时排出的空气在标准状况下是40mL,则该化合物的相对分子质量是( )
A.80 B.112 C.168 D.340
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com