
18.(10分)卤素互化物是指不同卤素原子之间以共价键结合形成的化合物;氰(CN)2称之为拟卤素。它们的化学性质与卤素很相似。试回答下列问题:
(1)卤素互化物BrCl能发生下列反应:
H2O+BrCl===HBrO+HCl;KBr+BrCl===KCl+Br2。
①在下列关于ICl的叙述中不正确的是___________
A.ICl是一种有色物质,固态时属分子晶体
B.在许多反应中ICl是强氧化剂
C.在ICl与水的反应中,它既是氧化剂又是还原剂
D.ICl与NaOH溶液反应可生成NaClO
②写出KI与ICl反应的化学方程式______________________________________ 。
(2)下图是部分卤素单质和XX’型卤素互化物的沸点与其相对分子质量的关系图。它们的沸点随着相对分子质量的增大而升高,其原因是__________________________

(3)①写出氰与苛性钠溶液反应的化学方程式:______________________________。
②已知氰分子键之间夹角为180°并有对称性,且所有原子均满足8电子结构,则:
(CN)2的电子式为__________,(CN)2分子为_____ (填“极性”或“非极性”)分子。
17.(14分)在实验室可用下图所示装置制取氯酸钾、次氯酸钾和探究氯水的性质。
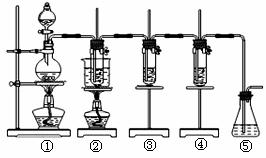
图中:①为氯气发生装置; ②的试管里盛 有15mL30%KOH 溶液.并置于水浴中;
③的试管里盛有15mL 8 % KOH 溶液.并置于冰水浴中;
④的试管里加有紫色石蕊试液;
⑤为尾气吸收装置。请填写下列空白:
(1)在反应前用手掌紧贴烧瓶外壁检查装置的气密性,如观察不到明显的现象,还可以用什么简单的方法证明该装置不漏气_____________________________
(2)制取氯气时,在烧瓶里加人一定量的二氧化锰,通过_______(写仪器名称)向烧瓶中加入适量的浓盐酸。写出装置①中发生反应的化学方程式_____________
(3)实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有______的净化装置。
A.碱石灰 B.饱和食盐水 C.浓硫酸 D.饱和碳酸氢钠溶液
(4)氯酸钾在装置_____中(填装置序号)生成。本实验中制取氯酸钾的离子方程式是:______
(5)比较制取氯酸钾和次氯酸钾的条件,二者的差异是:___________________________
(6)实验中④的试管里溶液的颜色变化过程为:紫色→红色→无色→_________,从红色变无色的原因是____________。
16.体积为V mL,密度为ρg·mL-1的含有相对分子质量为M的某物质的溶液,其中溶质为m g,其物质的量浓度为c mol/L,溶质的质量分数为ω,则下列表示正确的是 ( )
A. B.
B.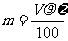 C.
C. D.
D.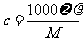
15.如图所示,a、b、c均为石墨电极,d为碳钢电极,通电进行电解。假设在电解过程中产生的气体全部逸出,下列说法正确的是 ( )

A.甲、乙两烧杯中溶液的pH均保持不变
B.甲烧杯中a的电极反应式为4OH――4e-=O2↑+2H2O
C.当电解一段时间后,将甲、乙两溶液混合,一定会产生蓝色沉淀
D.当b极增重3.2g时,d极产生的气体为2.24L(标况)
14.下列说法正确的是 ( )
A.进行SO2性质探究实验时,多余的SO2应排到实验室外
B.硫的化合物常存在于火山喷出的气体中和矿泉水里
C.SO2气体通入BaCl2溶液中会产生白色沉淀
D.硫在空气中的燃烧产物是二氧化硫,在纯氧中的燃烧产物是三氧化硫
13.下列说法正确的是 ( )
A.已知某元素的最高化合价为+7价,该元素在元素周期表中一定处于ⅦA族
B.ⅥA族元素的氢化物中,稳定性最好的其沸点也最高
C.全由极性键构成的共价分子不可能是非极性分子
D.第三周期元素的离子半径从左到右逐渐减小
12.已知短周期元素的离子aW2+、b X+、cY2-、d Z- 具有相同的电子层结构,下列正确的是( )
A.原子序数:a>b >c>d B.离子的还原性:Y2-> Z-、
C.氢化物的稳定性H2Y>HZ D.原子半径X<W
11.在盛有50 ml澄清饱和石灰水的小烧杯中放入一小块钠,不可能观察到的现象是( )
A.钠熔化成银白色小球 B.在液面快速游动
C.溶液底部出现银白色固体 D.溶液变浑浊
10.下列各组中两种气体所含的原子数一定相等的是: ( )
A.温度相同,体积相同的O2和N2 B.质量相等,密度不等的N2和CO
C.体积相等,密度相等的CO和C2H4 D.压强相同、体积相同的N2和O2
9.设NA代表阿伏加德罗常数,下列说法正确的是 ( )
A.5.6 g铁与过量盐酸反应转移的电子数为0.3NA
 B.常温下,10ml
1mol/LNa2CO3溶液中阴离子总数大于0.01NA
B.常温下,10ml
1mol/LNa2CO3溶液中阴离子总数大于0.01NA
C.标准状况下,22.4 L氦气与22.4 L氢气所含原子数均为2NA
 D.30gSiO2中含Si-O键数目为NA
D.30gSiO2中含Si-O键数目为NA
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com