
8.下列离子方程式正确的是 ( )
A.在氢氧化钙溶液中加入少量小苏打:
Ca2++OH-+HCO3-===CaCO3↓+H2O
B.电解氯化镁:2Cl-+2H2O H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
C.Na2S溶于水:S2-+2H2O H2S+2OH-
H2S+2OH-
D.铜片溶于稀硝酸:Cu+NO3-+4H+====Cu2++NO↑+2H2O
7.在下列各说法中,正确的是 ( )
A.热化学方程式中的化学计量数表示物质的量,所以可以是分数
B.△H>0 KJ·mol-1表示放热反应,△H<0KJ·mol-1表示吸热反应
C.1molH2SO4与1molBa(OH)2反应生成BaSO4沉淀时放出的热叫做中和热
D.1molH2与0.5molO2反应放出的热就是H2的燃烧热
6.在一定条件下,硝酸铵受热分解的化学方程式为:NH4NO3-HNO3+N2↑+H2O(未配平),在此反应中被氧化与被还原的氮原子数之比为 ( )
A.5:3 B.5:4 C.1:1 D.3:5
5.下列有关晶体的叙述中,不正确的是 ( )
A.金刚石的网状结构中,由共价键形成的碳原子环,其中最小环上有6个碳原子
B.在氯化铯晶体中,每个Na+或Cl-的周围紧邻6个Cl-或6个Na+
C.在氯化铯晶体中,每个Cs+周围紧邻8个Cl-,每个Cl-周围紧邻8个Cs+
D.干冰晶体溶化时,1mol干冰时要断裂2mol碳氧双键
4.二氧化硫催化氧化是放热反应。下列关于接触法制硫酸的叙述中正确的是 ( )
A.为防止催化剂中毒,炉气在进入接触室之前需要净化
B.为提高SO2的转化率,接触室内反应温度选定在400°C~500°C
C.为防止污染大气,从吸收塔出来的尾气常用NaOH溶液吸收
D.为提高SO3的吸收效率,用稀硫酸代替水吸收SO3
3.下列关于电解法精炼粗铜的叙述中不正确的是 ( )
A.粗铜板作阳极
B.电解时,阳极发生氧化反应,而阴极发生的反应为:Cu2++2e-=Cu
C.粗铜中所含Ni、Fe、Zn等金属杂质,电解后以单质形式沉积糟底,形成阳极泥
D.电解铜的纯度可达99.95%~99.98%
2.1g氢气燃烧生成液态水,放出142.9KJ热量,下列表示该反应的热化学程式正确的是
( )
A.H2(g)+1/2O2(g)=H2O(1);△H=-285.9KJ/mol
B.2H2(g)+O2(g)=2H2O(1);△H=-142.9KJ/mol
C.2H2(g)+O2(g)=2H2O(1);△H=-571.6KJ/mol
D.2H2(g)+O2(g)=2H2O(1);△H=+571.6KJ/mol
1.下列过程需要通电才能进行的是 ( )
①电离 ②电解 ③电镀 ④电泳 ⑤电化腐蚀
A.①②③ B.②③④ C.②④⑤ D.全部
20.(16分)以黄铁矿为原料生产硫酸的工艺流程图如下:

(1)填写工业设备名称
①________________②________________③________________
(2)写出煅烧黄铁矿的
化学反应方程式: ___ _________
(3)依据工艺流程图判断下列说法正确的是(选填序号字母) _____。
a.为使黄铁矿充分燃烧,需将其粉碎
b.过量空气能提高SO2的转化率
c.使用催化剂能提高SO2的反应速率和转化率
d.设备①排出的矿渣可供炼铁
(4)吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的SO2和铵盐。
①SO2既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气 中的Br2。SO2吸收Br2的离子方程式是 __________________ 。
②为测定上述铵盐中(NH4)2SO4和NH4HSO4的比例,现称取该样品四份,分别加入相同浓度的NaOH溶液各40.00mL,加热至120℃左右,使氨气全部逸出[(NH4)2SO4和NH4HSO4的分解温度均高于200℃],测得有关实验数据如下(标准状况):
|
实验序号 |
样品的质量/g |
NaOH溶液的体积/mL |
氨气的体积/L |
|
Ⅰ |
7.4 |
40.00 |
1.68 |
|
Ⅱ |
14.8 |
40.00 |
3.36 |
|
Ⅲ |
22.2 |
40.00 |
1.12 |
|
Ⅳ |
37.0 |
40.00 |
0.00 |
(Ⅰ)3.7g样品进行同样实验时,生成氨气在标准状况下的体积为________L。
(Ⅱ)试计算该混合物中(NH4)2SO4和NH4HSO4的物质的量之比。
21(6分)将20.0g的NaHCO3与NaOH的混合物放在密闭容器中加热到 3000C,充分反应后排出气体,剩余固体残渣为17.3g。
(1)固体残渣的成分是____。
A.只含Na2CO3 B.只含NaOH C.Na2CO3与NaOH
D.Na2CO3与NaHCO3 E.Na2CO3、NaHCO3与NaOH
(2)计算原混合物中NaOH的质量分数。
19.(14分)以下是元素周期表的一部分,根据图示回答下列问题:
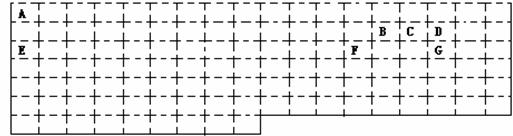
(1)请在表中用实线补全元素周期表的边界
(2)A、C形成的10电子阳离子的空间构型是________________;
写出工业上由GD2合成GD3 的化学方程式_________________________________;
(3)E在D2中燃烧生成的化合物X中阴阳离子的个数比为____________;X中的化学键类型是_____________________;晶体类型是_______________。
(4)2.00gB2A2完全燃烧生成BD2和液态A2D,放出99.6KJ热量,写出B2A2燃烧热的热化学反应方程式______________________________________________________;
(5)BD2的电子式为___________;向含E的最高价氧化物的水化物0.05 mol的水溶液中通入标况下BD2气体1.12L,其反应离子方程式是_____________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com