
3.我国稀土资源丰富。下列有关稀土元素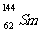 与
与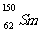 的说法正确的是
的说法正确的是
A.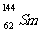 与
与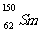 互为同素异形体
互为同素异形体
B.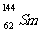 与
与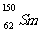 的核外电子数和中子数均为62
的核外电子数和中子数均为62
C.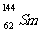 质子数和中子数比为1:1
质子数和中子数比为1:1
D.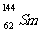 与
与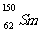 是不同核素
是不同核素
2.下列变化一定属于化学变化的是
A.爆炸 B.变色 C.变性 D.潮解
1.下列化学用语使用正确的是
A.四氯化碳的电子式 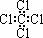 B.Cl-的结构示意图
B.Cl-的结构示意图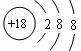
C.聚乙烯的结构简式为CH2=CH2 D.NH4ClO4中氯元素的化合价为+7
27.(14分)A为中学化学常见金属单质,将A投入足量B的浓溶液中,溶液总质量在反应前后保持不变(忽略沉淀或气体的溶解)。除A、C外其余各物质均含同一种元素X,F为X的氢化物,G为淡黄色固体,H为黑色沉淀
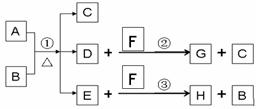
(1)写出下列物质的化学式
A D F G H ,
写出反应①的化学反应方程式
(2)G和过量NaOH溶液在加热时反应,氧化产物与还原产物的物质的量之比为1:2,写出该反应的离子方程式
(3)检验E中阴离子的操作方法为:
选考题(每科选做1题)
26.(13分)虽然氟元素早在1810年就被发现,但170多年来化学家试图用化学方法制取氟单质的尝试一直未获成功。直到1986年,化学家Karl Christe首次用学化方法制得了F2。他提出的三步反应如下(反应①、②里氟元素化合价不变):
①KMnO4+KF+H2O2+HF→K2MnF6+ +H2O
②SbCl5+HF→SbF5+
③2K2MnF6+4SbF5→4KSbF6+2MnF3+F2↑
请根据以上反应回答问题:
(1)反应①中空格上应填物质的化学式为 ,为什么填这一物质,试用氧化还原反应理论解释: 。
(2)完成反应②: 。
(3)反应③中的氧化剂为 ,被氧化的元素为 。
(4)配平反应①,并标出电子转移的方向和数目。(将答案写在下面空格上)
。
25.(16分)Ⅰ 海水中蕴藏着丰富的资源。海水综合利用的流程图如下。
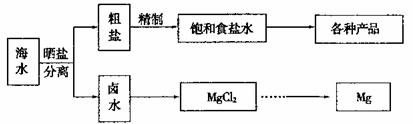
用NaCl做原料可以得到多种产品。
①工业上由NaCl制备金属钠的化学方程式是 。
②实验室用惰性电极电解500mL0.1mol/LNaCl溶液,若阴阳两极共得到112mL气体(标准状况),则所得溶液的pH为 (忽略反应前后溶液的体积变化)
③电解NaCl稀溶液可制备“84消毒液”,通电时产生的氯气被溶液完全吸收,若所得消毒液仅含一种溶质,写出该电解的总化学方程式: 。
Ⅱ 铝粉是铝热剂的主要成份之一,常用铝锭制得的铝粉中含有少量的Al2O3和SiO2,用如图所示的装置(甲、乙管用橡皮管连接可上下移动)测定铝粉中金属铝的含量,其方法是:用稀硫酸或氢氧化钠溶液与样品作用,通过产生的气体体积计算样品中金属铝的含量,根据实验原理回答下列问题:

(1)装置中导管a所起的作用是 。
(2)为了较准确测量产生的气体体积,在反应前后读取甲管液面的读数时应注意 。
A.反应前后读取甲管液面数据时应使甲、乙中液面保持水平
B.反应后读取甲管液面数据时,甲、乙两管液面无须保持水平
C.反应后立即读取甲管液面数据,防止液面变动
D.反应后静置一会,需待反应器恢复原来温度
(3)若从稀硫酸和氢氧化钠溶液中挑选一种试剂,你选择的试剂是 ,不选择另一种试剂的理由是 。
13.在一含Na+的澄清溶液中,可能还存在NH4+、Fe2+、I-、Br-、CO32-、SO32-六种离子中的几种。①在原溶液中滴加足量的饱和氯水后,有气泡生成,溶液呈橙黄色;②向呈橙黄色的溶液中加入BaCl2溶液时无沉淀生成;③橙黄色溶液不能使淀粉溶液变蓝色。根据上述实验事实推断,下列说法不正确的是
A.溶液中一定存在Br-、CO32- B.溶液中可能存在NH4+
C.溶液中一定不存在Fe2+、I-、SO32- D.溶液一定呈碱性
第Ⅱ卷
必考题
12.NA为阿伏加德罗常数的数值,下列说法正确的是
A.一定条件下,足量铜与200g 98%的硫酸溶液充分反应,转移电子数目为NA
B.常温下,10L pH=3的醋酸溶液中H+ 的数目为0.01NA
C.22.4L由CO2和O2组成的混合气体中含有氧原子个数为2NA
D.18g D2O中含质子数为10NA
11.2005年美国《Science》上发表论文,宣布发现了一种Al的超原子结构,这种超原子(Al13)是以1个Al原子在中心,12个Al原子在表面形成的三角二十面体结构。这种超原子具有40个价电子时最稳定。请预测稳定的Al13所带的电荷为
A.3 + B.2 + C.0 D.1-
10.有200mLMgCl2和AlCl3混合液,其中c(Mg2+)为0.2mol/L,c(Cl-)为1.3mol/L,欲将Mg2+、Al3+恰好转化为沉淀,需加4mol/LNaOH溶液
A.65mL B.40mL C.72mL D.128mL
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com