
13.下列各项表述中正确的是 ( )
A.由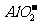 与
与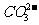 在溶液中可以共存,推测:
在溶液中可以共存,推测: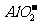 与
与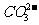 在溶液中可以共存
在溶液中可以共存
B.足量的氢氧化钙溶液中滴加少量的碳酸氢镁:
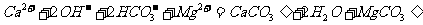
C.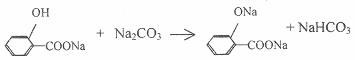
D.碘化亚铁溶液通入一定量的氯气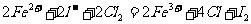
第II卷
12.在化学反应中,有时存在“一种物质过量,另一种物质仍不能完全反应”的情况。下列反应中属于这种情况的是 ( )
①过量的锌与浓硫酸反应 ②过量的氢气与少量的N2在工业生产条件下
③过量的浓盐酸与碳酸钙反应 ④过量的乙酸和少量乙醇在浓硫酸、加热条件下
⑤过量二氧化锰与浓盐酸在加热条件下⑥过量的铜与浓硫酸在加热条件下
A.②③④⑥ B.②④⑤⑥ C.①②④⑤ D.③④⑤⑥
11.用Pt作电极,电解串联电路中分装在甲、乙两个烧杯中的200mL0.3mol/LnaCl溶液和现300mL0.15mol/L的AgNO3溶液,当甲中产生0.56L(标准状况)Cl2时停止电解,取出电极,将两杯溶液混合,混合液在室温下的pH为(设混合后总体积为500mL,且所产生的Cl2全部逸出) ( )
A.2 B.7 C.11.7 D.12
10.对于可逆反应:2A(g)+B(g)  2C(g);△H<0,下列各图正确的是(设变化过程中物质的聚集状态没有发生改变) ( )
2C(g);△H<0,下列各图正确的是(设变化过程中物质的聚集状态没有发生改变) ( )
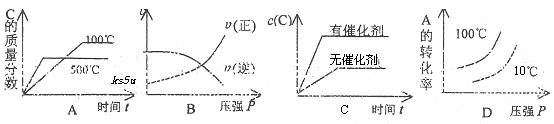
9.下列说法或表示法正确的是 ( )
A.在101kPa时,2g是H2完全燃烧生成液态水,放出285.8kJ热量,则氢气燃烧的热化学方程式为2H2(g)+O2(g)=2H2O(1);△H=-258.8kJ·mol-1
B.等量的白磷蒸气和白磷固体分别完全燃烧,后者放出热量多
C.根据中和热△H=-57.3kJ·mol-1,可知将含0.5molH2SO4的溶液与含1molNaOH的溶液混合,放出的热量一定等于57.3kJ
D.由C(S,石墨)→C(S,金刚石);△H=+1.9kJ·mol-1可知,石墨比金刚石稳定
8.有A、B、C、D、E、F六瓶不同物质的溶液,它们各是NH3·H2O、Na2CO3、MgSO4、NaHCO3、HNO3和BaCl2溶液中的一种。为了鉴别它们,各取少量溶液进行两两混合,实验结果如下表所示。表中“↓”表示生成微溶物或沉淀,“↑”表示生成气体,“-”表示观察不到明显现象,空格表示实验未做。试推断其中F是 ( )
A.Na2CO3溶液 B.BaCl2溶液
C.MgSO4溶液 D.NaHCO3溶液
7.把3g甲醛气体溶于6g冰醋酸中,再加入4g果糖得混合物甲;另取5g甲酸酯和9g葡萄糖相混合得混合液乙;然后将甲和乙两种混合液再按7:4的质量比混合得丙。丙中碳元素的质量分数是 ( )
A.20% B.35% C.40% D.55%
6.下列说法正确的是 ( )
A.石炭酸、氨水、苏打和干冰分别属于酸、碱、盐和氧化物
B.鼠李糖、重晶石和冰醋酸分别属于非电解、强电解质和弱电解质
C.碘有极其重要的生理作用,多多摄入高碘的食物对人体有益
D.为了防止食品受潮及氧化变质,常在包装袋中加入无水硫酸铜和还原铁粉
25.计算题(本题共11分)
已知:工业制硝酸涉及下列重要的反应:
4NH3+5O2 4NO+6H2O; 4NO+3O2+2H2O
4NO+6H2O; 4NO+3O2+2H2O 4HNO3
4HNO3
设空气中氧气的体积分数为0.20,氮气体积分数为0.80,请完成下列填空及计算:
(1)amol NO完全转化为HNO3需要氧气的物质的量 n(O2)=____________mol;(3分)
(2)现有氨气和空气组成的混合气体,为使NH3和空气中的氧气恰好完全反应生成一氧化氮,则氨气和空气组成的混合气体中氨的体积分数为_________(保留2位小数)(4分)
(3)硝酸工业生产中的尾气有NO 和NO2 气体,可用纯碱溶液吸收,有关的化学反应为:
2NO2 + Na2CO3 → NaNO2 + NaNO3 + CO2↑ ①
NO + NO2 + Na2CO3 → 2NaNO2 + CO2↑ ②
现有1000g质量分数为21.2%的纯碱吸收液,吸收硝酸工业尾气,每产生22.4L(标准状况)CO2时,吸收液质量增加44g。
计算吸收液中NaNO2和NaNO3物质的量之比。(4分)
24.(共18分)氮、磷和砷(As) 三种元素位于同一主族,他们的单质及其化合物有广泛用途。
(1)有关于As的反应中,反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X
①已知KBrO3在反应中得到电子,则该反应的还原剂是 。
②已知0.2mol KBrO3在反应中得到1mol电子生成X,则X的化学式为 。
③根据上述反应可推知 。
A.氧化性:KBrO3>H3AsO4 B.氧化性:H3AsO4> KBrO3
C.还原性:AsH3>X D.还原性:X > AsH3
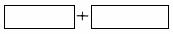
④将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中:
(2)①关于P元素,可以形成多种含氧酸,如磷酸(H3PO4)、亚磷酸(H3PO3)、次磷酸(H3PO2)磷酸结构式见下图,三聚磷酸可视为三个磷酸分子之间脱去两个分子产物,其结构式为 。三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为 。
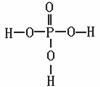
②已知亚磷酸的化学式为H3PO3、结构式如下图所示,则H3PO3为__________元酸,Na2HPO3为 盐(填“正盐”或“酸式盐”)
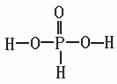
③次磷酸(H3PO2)与NaOH溶液作用形成次磷酸钠,次磷酸钠(NaH2PO2)可用于化学镀镍。NaH2PO2中P元素的化合价为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com