
6、 A、B两种物质的饱和溶液的质量分数随温度变化的曲线如下图。现分别在50gA和80gB中各加水150g加热溶解后并都蒸发掉水50g,冷却到t1℃,下列叙述正确的是( )

A.t1℃时溶液中A、B的质量分数相等
B.t1℃时溶液中A的物质的量浓度等于B的物质的量浓度
C.t1℃时析出固体B
D.t1℃时两者均无固体析出
5、铁屑溶于过量的稀硫酸,过滤后向滤液中加入适量硝酸,再加入过量的氨水,有红褐色沉淀生成。过滤、加热沉淀物至质量不再发生变化,得到红棕色的残查。上述沉淀和残渣分别为( )
A.Fe(OH)3;Fe2O3 B.Fe(OH)2;FeO
C.Fe(OH)2、Fe(OH)3;Fe3O4 D.Fe2O3;Fe(OH)3
4、含有Na+的澄清溶液中,可能还存在NH+4、Fe2+、I-、Br-、CO2-3、SO2-3六种离子中的几种。将该溶液进行如下实验:①滴加足量的新制氯水,有气泡生成,溶液变黄色;②向①中所得溶液中加入BaCl2溶液,无沉淀生成;③向①中所得溶液中加入淀粉溶液,不显蓝色。依据上述实验事实推断该溶液( )
A.一定存在Fe2+、Br-、CO2-3 B.一定是呈碱性
C.可能存在I-、SO2-3 D.可能存在NH+4
3、将SO2气体与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,发生如下两个化学反应:SO2+2Fe3++2H2O═SO2-4+2Fe2++4H+,Cr2O2-7+6Fe2++14H+=2Cr3++6Fe3++7H2O,有关说法正确的是( )
A.还原性Cr3+ >Fe2+>SO2 B.氧化性Cr2O2-7>SO2>Fe3+
C.两个反应中Fe2(SO4)3均作还原剂 D.Cr2O2-7能将Na2SO3氧化成Na2SO4
2、某溶液中含HCO-3、SO2-3、CO2-3、CH3COO-等四种阴离子,向其中加入足量的Na2O2
固体后,假设溶液体积无变化,溶液中离子浓度基本保持不变的是( )
A.CH3COO- B.HCO-3 C.CO32- D.SO42-
1、在下列溶液中,各组离子一定能够大量共存的是( )
A.使酚酞试液变红的溶液:Na+、Cl-、SO42-、Fe3+
B.使紫色石蕊试液变红的溶液:Na+、Fe2+、NO3-、Cl-
C.c(H+)=10-12mol·L-1的溶液:K+、Ba2+、Cl-、Br-
D.碳酸氢钠溶液:K+、SO2-4、Cl-、H+
29.(15分)一切植物中均含有天然有机高分子化合物A,它是构成植物细胞壁的基础物质,不溶于水,也不溶于一般有机溶剂。能发生如下变化(A-F均分别代表一种物质,框图中的部分产物已略去)
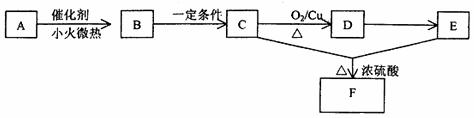
(1)由A生成B所使用的催化剂是 ,所得到的溶液的颜色是 ,化学方程式为 。
(2)B、D均含有的官能团是 ,设计实验,用弱氧化剂检验(1)所得到的溶液中的B分子结构中存在该官能团(要求:所需仪器和药品可以任选,如需采用实验室不能长期保存的试剂请写出它的制备过程;以下步骤可以填不满。)
①
②
③
④
⑤
(3)从A到F发生的反应类型有
A.氧化 B.酯化 C.消去 D.水解
(4)写出C到D所发生的化学反应的化学方程式
(5)F有多种同分异构体,请写出与它有相同官能团的所有同分异构体
28.(15分)
I.下列实验操作、试剂保存方法和实验室事故处理,一定正确的是 (填序号)。
A.实验室中,浓硝酸保存在带橡胶塞的棕色细口试剂并中;
B.制备氢氧化铁胶体时,应向20mL沸水中逐滴滴加1~2mL饱和的FeCl3溶液,并继续加热到液体呈透明的红褐色为止;
C.在石油的分馏实验中,温度计需插入液体中;
D.不慎将浓碱液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸溶液;
E.用酸式滴定管量取20.00mL高锰酸钾酸性溶液;
F.在进行中和热测定时,为保证实验的准确性,我们可以采取以下具体措施:使用碎泡沫以起到隔热保温的作用、使用铜质搅拌棒进行搅拌、取用的碱溶液略过量、进行两到三次实验取平均值。
II.无水CuSO4在500℃以上按下式分解:CuSO4 CuO+SO3↑+SO2↑+O2↑(未配平),某同学为测定一定量的CuSO4受热分解所产生的SO3、SO2、O2的物质的量,从而通过计算来确定该条件下CuSO4分解方程式中各物质的化学计量数。实验的主要仪器如下:
CuO+SO3↑+SO2↑+O2↑(未配平),某同学为测定一定量的CuSO4受热分解所产生的SO3、SO2、O2的物质的量,从而通过计算来确定该条件下CuSO4分解方程式中各物质的化学计量数。实验的主要仪器如下:
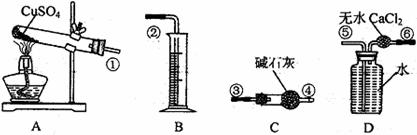
实验所测得数据及有关事项如下:
a.准确称取6.4g无水CuSO4;
b.装置C在实验结束时增重2.88g;
c.实验结束后,测量量筒中水的体积后,折算成排出水的气体的体积(标准状况下)为224mL。
(1)按装置从左至右的方向,各仪器接口的连接次序为 (用圆圈数字表示)。
(2)500℃以上CuSO4分解的产物中,能被碱石灰吸收的气体有 (填分子式)。
(3)D装置中无水CaCl2的作用是: 。
(4)实验前,还应向盛满水的D装置中通入O2(所需的O2另用它法制取)使之达饱和,这样操作的目的是 。
(5)假设CuSO4完全分解且所有气体全被吸收或排出,通过题中所给的数据进行必要计算,CuSO4完全分解所得SO3的物质的量是 mol,该条件下无水CuSO4分解的化学方程式是 。
27.(15分)下表是元素周期表的一部分,表中所列字母分别代表某一化学元素。
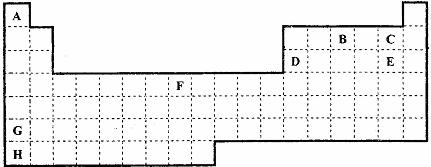
(1)在表中画出主族与非主族的交界线(不考虑零族元素),并分别用“△”将每个周期的第一个非金属所在的位置标同。
(2)字母H表示的元素符号为 该元素的名称是 。
(3)比较C和E气态氢化物水溶液的酸性强弱: > (填化学式)
比较G和D单质的熔点高低: > (填化学式)
(4)工业制硝酸的基础是对元素 和 (填上表中的字母代号)形成的化合物 (填化学式)进行催化氧化,该反应的化学方程式为
(5)F单质在E单质中燃烧,产生 (描述实验现象)这是 (填物质名称)。加水振荡后,得到 溶液(描述颜色)。
26.(15分)W、X、Y、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Y、Z是非金属元素。
(1)W、X各自的最高价氧化物对应的水化物可以反应生成盐和水。向该盐的溶液中滴加足量的盐酸,随着盐酸的逐滴加入,所观察到的现象是 ,反应结束时,该反应的总反应离子方程式为 。
(2)W与Y可形成化合物W2Y,该化合物的电子式为 。它的水溶液中存在多种离子,请根据电荷守恒写出一个用离子浓度表示的等式: 。
(3)若甲为W的最高价氧化物对应的水化物,乙为Y的氢化物。
现有①0.2mol/甲的溶液和②0.2mol/L乙的溶液,则①中由水电离出的c(OH-) ②中由水电离出的c(OH+)。(填“>”、“=”或“<”)
(4)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com