
3.工业制备纯硅的反应:SiCl4(g)+2H2(g) Si(s)+4HCl(g);△H=QkJ·mol-1(Q>0),某温度、压强下,将一定量的反应物通入密闭容器进行以上反应,下列叙述正确的是
Si(s)+4HCl(g);△H=QkJ·mol-1(Q>0),某温度、压强下,将一定量的反应物通入密闭容器进行以上反应,下列叙述正确的是
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1mol,则达到平衡时,吸收热量为QkJ
C. 反应至4min时,若HCl的浓度为0.12mol·L-1,则H2的反应速率为0.03mol/(L·min)
D.当反应吸收热量为0.025QkJ时,生成的HCl通入100mL1mol·L-1的NaOH恰好反应
2.化学反应中通常伴随着能量变化,下列说法中错误的
A.煤燃烧时将部分化学能转化为热能
B.电解熔融Al2O3时将部分化学能转化为电能
C.TNT爆炸时将部分化学能转化为动能
D.镁条燃烧时将部分化学能转化为光能
1.下列反应中生成物总能量高于反应物总能量的是
A.碳酸钙受热分解 B.乙醇燃烧
C.铝粉与氧化铁粉末反应 D.氧化钙溶于水
32.(12分)已知漂白粉的有效成分能与浓盐酸反应生成Cl2和一种固体时能作干燥剂的物质。请从下图中选用适当的实验装置,设计一个最简单的实验,测定漂白粉有效成分的质量分数。

请填写下列空白:.
(1)实验中漂白粉有效成分与浓盐酸反应的化学方程式为 。
(2)写出A中有关仪器的名称:______________,_________________。
(3)所选用装置有(填装置序号) 。
(4)在读取量筒的刻度数时,应注意 、 、 。
(5)若各仪器内仍残留有少量Cl2,则测定结果将(填“偏高”、“偏低”或“不影响”)
,其原因是 。
(6)某同学在实验中发现量筒里未收集到液体,其失败的原因可能是下列中的(填A、B、C等代号) 。①装置漏气②浓盐酸已变成稀盐酸③所选仪器容积太大④漂白粉已全变质⑤e接f ⑥d接f
A.①②③ B.①②④⑤ C.①②④⑥ D.全部
31.(9分)下图中A-J均代表无机物或其水溶液,其中B、D、G是单质,B是地壳中含量最高的金属元素,G是气体,J是磁性材料。根据图示回答问题:
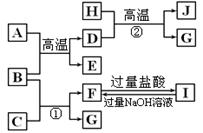
(1)写出下列物质的化学式:A ,I ;
(2)D在周期表中的位置 。
(3)反应①的离子方程式是 ;
(4)反应②的化学方程式是 ;
(5)F与过量的CO2反应的离子方程式是 。
30.(6分)一定量的液体混合物,在一定量的O2中恰好完全燃烧,反应方程式为:XY2(l)+3O2(g)=XO2(g)+2YO2(g) 冷却后,在标况下测得生成物的体积是672mL,密度是2.56g/L。
(1)反应前O2的体积 mL(标况下)
(2)化合物XY2的摩尔质量是 。
(3)若XY2中X、Y两元素的质量比是3:16,则X、Y两元素分别是 。
29.(6分)C和Si元素在化学中占有极其重要的地位。
(1)写出Si的基态原子核外电子排布式 。从电负性角度分析,C、Si和O元素的非金属活泼性由强至弱的顺序为 。
(2)SiC的晶体结构与晶体硅的相似,C原子的杂化方式为 ,微粒间存在的作用力是 。
(3)氧化物AO的电子总数与SiC的相等,则A为 (填元素符号),AO是优良的耐高温材料,其晶体结构与NaCl晶体相似,AO的熔点比CaO的高,其原因是 。
28.(6分)已知NaCl溶液的体积为VmL,密度为 g/cm3,质量分数为W%,物质的量浓度为C mol/L,溶液中含NaCl的质量为m g。
g/cm3,质量分数为W%,物质的量浓度为C mol/L,溶液中含NaCl的质量为m g。
(1)用m、V表示溶液物质的量浓度
(2)用w、 表示溶液物质的量浓度
表示溶液物质的量浓度
(3)用C、 表示溶液的质量分数
表示溶液的质量分数
27.(4分)填写下列物质分离时需使用的方法(不必叙述操作细节)。
(1)两种互不相溶的液体的分离 。
(2)含化学性质稳定的固体溶质的水溶液中除去部分溶剂 。
(3)胶体中分离出电解质溶液 。
(4)几种沸点相差较大的互溶液体的分离 。
26.(2分)一定条件下,RO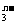 和I-发生反应如下:RO
和I-发生反应如下:RO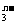 +6I-+6H+===R-+3I2+3H2O。
+6I-+6H+===R-+3I2+3H2O。
(1)RO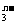 中R元素的化合价为_______。
中R元素的化合价为_______。
(2)R元素原子的最外层电子数是________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com